
���� ��1����ѧƽ�ⳣ��K����������Ũ����֮���뷴Ӧ��Ũ����֮���ıȣ�
��2��830K�¶��£�����ʼʱc��CO��=2mol•L-1��c��H2O��=3mol•L-1���ﵽƽ��ʱCO��ת����Ϊ50%����Ӧ��c��CO��=2mol/L��50%=1mol/L��
CO��g��+H2O��g��?CO2��g��+H2��g����H��0
��ʼ��mol/L��2 3 0 0
��Ӧ��mol/L��1 1 1 1
ƽ�⣨mol/L��1 2 1 1
��ѧƽ�ⳣ��K=$\frac{c��C{O}_{2}����c��{H}_{2}��}{c��CO����c��{H}_{2}O��}$��
��3�������¶�ƽ�������ȷ����ƶ������淴Ӧ����С��
��4������ͨ���ı�Ũ�ȣ���COŨ�ȣ����¶����ı�COת���ʣ�
��5��CO��g��+H2O��g��?CO2��g��+H2��g����H��0
��ʼ��mol/L��1 2 0 0
��Ӧ��mol/L��0.5 0.5 0.5 0.5
ijʱ�̣�mol/L��0.5 1.5 0.5 0.5
�ȼ���Ũ���̣�����Ũ�����뻯ѧƽ�ⳣ����Դ�Сȷ����Ӧ�������Ũ���̵���ƽ�ⳣ������÷�Ӧ�ﵽƽ��״̬��
��� �⣺��1����ѧƽ�ⳣ��K����������Ũ����֮���뷴Ӧ��Ũ����֮���ıȣ���÷�Ӧ��ѧƽ�ⳣ��K=$\frac{c��C{O}_{2}����c��{H}_{2}��}{c��CO����c��{H}_{2}O��}$��
�ʴ�Ϊ��K=$\frac{c��C{O}_{2}����c��{H}_{2}��}{c��CO����c��{H}_{2}O��}$��
��2��830K�¶��£�����ʼʱc��CO��=2mol•L-1��c��H2O��=3mol•L-1���ﵽƽ��ʱCO��ת����Ϊ50%����Ӧ��c��CO��=2mol/L��50%=1mol/L��
CO��g��+H2O��g��?CO2��g��+H2��g����H��0
��ʼ��mol/L��2 3 0 0
��Ӧ��mol/L��1 1 1 1
ƽ�⣨mol/L��1 2 1 1
��ѧƽ�ⳣ��K=$\frac{c��C{O}_{2}����c��{H}_{2}��}{c��CO����c��{H}_{2}O��}$=$\frac{1��1}{1��2}$=0.5��
�ʴ�Ϊ��0.5��
��3���÷�Ӧ������Ӧ�����ȷ�Ӧ�������¶�ƽ�������ƶ�����ѧƽ�ⳣ����С�������¶ȵ��»���Ӱٷ�����С�����淴Ӧ���ʼ�С��
�ʴ�Ϊ����С����С����С��
��4��Ҫ���COת���ʣ�����ͨ������ˮ����Ũ�ȡ���С������̼����С����Ũ�ȡ������¶���ʵ�֣�
�ʴ�Ϊ������ˮ����Ũ�ȡ���С������̼����С����Ũ�Ȼ������¶ȣ�
��5��CO��g��+H2O��g��?CO2��g��+H2��g����H��0
��ʼ��mol/L��1 2 0 0
��Ӧ��mol/L��0.5 0.5 0.5 0.5
ijʱ�̣�mol/L��0.5 1.5 0.5 0.5
Ũ����=$\frac{0.5��0.5}{0.5��1.5}$=0.33��K��ƽ�������ƶ�����Ӧû�дﵽƽ��״̬��
�ʴ�Ϊ����Ũ����=$\frac{0.5��0.5}{0.5��1.5}$=0.33��K��ƽ�������ƶ���
���� ���⿼�黯ѧƽ����㣬Ϊ��Ƶ���㣬���ؿ���ѧ���������������������������ʽ�ⷨ�ǽⱾ��ؼ��������Ũ�����뻯ѧƽ�ⳣ����Դ�Сȷ����Ӧ������Ŀ�ѶȲ���


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��H��0��ʾ���ȷ�Ӧ����H��0��ʾ���ȷ�Ӧ | |
| B�� | 0.5 mol H2SO4��0.5 mol Ba��OH��2��ȫ��Ӧ����BaSO4ʱ�ų����Ƚ����к��� | |
| C�� | 1 mol H2��0.5 mol O2��Ӧ�ų����Ⱦ���H2��ȼ���� | |
| D�� | �Ȼ�ѧ����ʽ�еĻ�ѧ������ֻ��ʾ���ʵ����������Ƿ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | N2�ĵ���ʽ��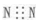 | |
| B�� | ������Ϊ53��������Ϊ78�ĵ�ԭ�ӣ�${\;}_{53}^{131}$I | |
| C�� | S2-�Ľṹʾ��ͼ��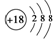 | |
| D�� | ��ϩ�ķ���ʽ��CH2=CH2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��±��ʯ����붹�����Ƴɶ��� | |
| B�� | ұ�����ø�ѹֱ�����ȥ�����۳� | |
| C�� | ��FeCl3��Һ�м���NaOH��Һ������ֺ��ɫ���� | |
| D�� | �ں�ˮ�뺣ˮ�Ľ��紦�����γ������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
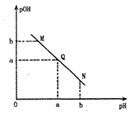 ij�¶��£���һ�����0.1mol•L-1�Ĵ�����Һ����μ��˵�Ũ�ȵ�NaOH��Һ����Һ�� pOH[pOH=-lgc��OH-��]�� pH �ı仯��ϵ�磬ͼ��ʾ��������
ij�¶��£���һ�����0.1mol•L-1�Ĵ�����Һ����μ��˵�Ũ�ȵ�NaOH��Һ����Һ�� pOH[pOH=-lgc��OH-��]�� pH �ı仯��ϵ�磬ͼ��ʾ��������| A�� | M����ʾ��Һ�ĵ�������ǿ��Q�� | |
| B�� | N ����ʾ��Һ�� c��CH3COO-����c��Na+�� | |
| C�� | Q������NaOH��Һ��������ڴ�����Һ����� | |
| D�� | M���N����ʾ��Һ��ˮ�ĵ���̶���ͬ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ԣ�A��=0.5mol/��L•min�� | B�� | �ԣ�B��=0.12mol/��L•s�� | C�� | �ԣ�C��=0.1mol/��L•s�� | D�� | �ԣ�D��=0.4mol/��L•min�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
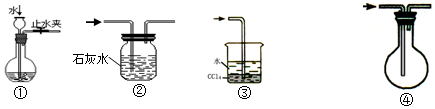
| A�� | װ�âٿ����ڼ��װ�õ������� | |
| B�� | װ�âڿ����ڳ�ȥCO�л��е�����CO2 | |
| C�� | װ�âۿ����ڰ�ȫ���ռ�������ˮ���Ȼ����������� | |
| D�� | װ�âܿ������ſ����ռ�CO |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ˢ��ʱ�ʵ�ʹ�ú��������ܹ�Ԥ��ȣ�� | |
| B�� | ȱп���˿��Է�������п�ǽ�����������п�Ȳ�п | |
| C�� | ������ȱ����ʹ���˻���״���״� | |
| D�� | ��Ȼ������ˮ��IJ��ﶼ�Ǧ�-������ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com