
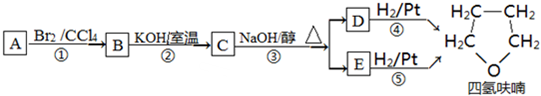
 +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$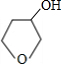 +NaBr.
+NaBr. ,根据提示的信息,模仿以下提示的流程图设计合成路线,以苯酚为主要原料合成
,根据提示的信息,模仿以下提示的流程图设计合成路线,以苯酚为主要原料合成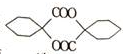 ,标明每一步的反应物及反应条件(有机物写结构简式,其它原料自选)
,标明每一步的反应物及反应条件(有机物写结构简式,其它原料自选)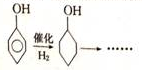
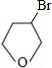
分析 Y为饱和一元醇,设其分子式为CnH2n+2O,则其中C的质量分数为$\frac{12n}{14n+18}$×100%=65%,解得n=4,即Y的分子式为C4H10O,1molA和1molH2恰好反应,则A分子式为C4H8O,且A能和Br2/CCl4反应,说明A分子中含有C=C,由信息卤代烃与醇反应生成醚,所以A中还含有-OH,结合四氢呋喃的结构,可知A为CH2=CHCH2CH2OH,故B为CH2BrCHBrCH2CH2OH,C为 ,D和E为
,D和E为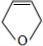 、
、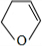 .
.
(6)用苯酚为主要原料合成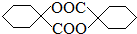 的工艺流程为:苯酚与氢气发生加成反应,生成环己醇,环己醇氧化生成环己酮,环己酮发生信息中反应生成
的工艺流程为:苯酚与氢气发生加成反应,生成环己醇,环己醇氧化生成环己酮,环己酮发生信息中反应生成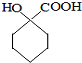 ,再根据酯化反应成环酯,得到
,再根据酯化反应成环酯,得到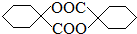 .
.
解答 解:Y为饱和一元醇,设其分子式为CnH2n+2O,则其中C的质量分数为$\frac{12n}{14n+18}$×100%=65%,解得n=4,即Y的分子式为C4H10O,1molA和1molH2恰好反应,则A分子式为C4H8O,且A能和Br2/CCl4反应,说明A分子中含有C=C,由信息卤代烃与醇反应生成醚,所以A中还含有-OH,结合四氢呋喃的结构,可知A为CH2=CHCH2CH2OH,故B为CH2BrCHBrCH2CH2OH,C为 ,D和E为
,D和E为 、
、 .
.
(1)由上述分析可知,A的分子式为:C4H8O,故答案为:C4H8O;
(2)反应①是CH2=CHCH2CH2OH与溴水发生加成反应,反应②是CH2BrCHBrCH2CH2OH发生取代反应生成 ,
,
故答案为:加成反应;取代反应;
(3)B为CH2BrCHBrCH2CH2OH,含有-OH可以发生氧化反应、可以在强酸(浓H2SO4)存在下发生消去反应、可以发生酯化反应,含有-Br可以在强碱(NaOH)存在下发生消去反应,不能发生加聚反应,
故答案为:ABC;
(4) 与NaOH水溶液反应的化学方程式:
与NaOH水溶液反应的化学方程式: +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$ +NaBr,
+NaBr,
故答案为: +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$ +NaBr;
+NaBr;
(5)四氢呋喃链状醚类的同分异构体的结构简式:CH2=CHOCH2CH3、CH2=CHCH2OCH3、CH3CH=CHOCH3、CH2=C(CH3)OCH3,共4种,
故答案为:4;
(6)用苯酚为主要原料合成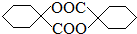 的工艺流程为:苯酚与氢气发生加成反应,生成环己醇,环己醇氧化生成环己酮,环己酮发生信息中反应生成
的工艺流程为:苯酚与氢气发生加成反应,生成环己醇,环己醇氧化生成环己酮,环己酮发生信息中反应生成 ,再根据酯化反应成环酯,得到
,再根据酯化反应成环酯,得到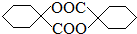 ,即为
,即为 ,
,
故答案为: .
.
点评 本题考查了有机物的推断与合成,需要学生对给予的信息加以应用,能较好的考查考生的阅读、自学能力和思维能力,是热点题型,难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 该反应在高温下才能自发进行 | |
| B. | 再加入一定量CO2,则n(CH3OH)/n(CO2)减小 | |
| C. | 温度升高,反应的平衡常数K增大 | |
| D. | 当CO2和H2转化率相等时,该反应达到化学平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 | 0.1MPa | 0.5MPa | 1MPa | 1.5MPa |
| 400℃ | 0.9961 | 0.9972 | 0.9984 | 0.9988 |
| 500℃ | 0.9675 | 0.9767 | 0.9852 | 0.9894 |
| 600℃ | 0.8520 | 0.8897 | 0.9276 | 0.9468 |
| 沸腾炉温度/℃ | 600 | 620 | 640 | 660 |
| 炉渣中CuSO4的质量分数/% | 9.3 | 9.2 | 9.0 | 8.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L1.0mo1•L-1的NaAlO2水溶液中含有的氧原子数为2NA | |
| B. | 标准状况下,11.2 LNO与11.2LO2混合后所含分子数为0.75NA | |
| C. | Na2O和Na2O2混合物的物质的量为1mol,其中含有的阴离子总数为NA | |
| D. | 室温下,将9g铝片投入0.5L18.4mol•L-1的H2SO4中,转移的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验方案 |
| A | 氯气的氧化性 | 将湿润的淀粉KI试纸放于充满 Cl2的集气瓶口,试纸变蓝 |
| B | 配制 480mL 0.2mol/L NaOH溶液 | 准确称量NaOH固体4.0g溶于水,配制成 500mL溶液 |
| C | 比较 H2CO3 和 H2SO4的酸性强弱 | 室温下,用PH试纸测定浓度为O.lmol•L-1Na2CO3溶液和 0.lmol•L-1NazSO4溶液的 pH |
| D | 证明氧化性: H2O2>Fe3+ | 用硫酸酸化的H2O2滴入Fe(NO3)2洛液中,浓液变黄色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>Y | B. | 最高价含氧酸酸性:W>R | ||
| C. | 气态氢化物稳定性:Y>R | D. | 简单离子半径:Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
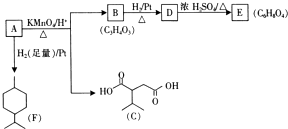
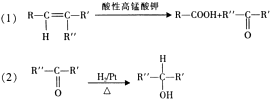
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com