
四种元素X、Y、Z、E位于元素周期表的前四周期,已知它们的核电荷数依次增大,Y原子的L层p轨道中有2个电子;Z原子的L电子层中,有三个未成对的电子,且无空轨道;E原子的L层电子数与最外层电子数之比为4∶1,其d轨道中的电子数与最外层电子数之比为5∶1。
(1)XYZ分子中的三个原子除X原子外最外层均为8电子构型,根据电子云重叠方式的不同,该分子中共价键的主要类型有________________。
(2)ZX3是一种常见气体,分子中Z原子的杂化方式是________,该物质易液化,极易溶 于水,其原因是____
于水,其原因是____ ______________________。
______________________。
(3)E元素+2价离子的核外电子排布式为________。
 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:
已知:锂离子电池的总反应为LixC+Li1-xCoO2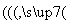 C+LiCoO2
C+LiCoO2
锂硫电池的总反应为2Li+S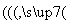 Li2S
Li2S
有关上述两种电池说法正确的是( )
A.锂离子电池放电时,Li+向负极迁移
B.锂硫电池充电时,锂电极发生还原反应
C.理论上两种电池的比能量相同
D.下图表示用锂离子电池给锂硫电池充电
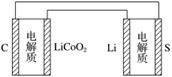
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于工业生产的说法正确的是
A.在侯氏制碱工业中,向饱和氯化钠溶液中先通二氧化碳,后通氨气
B.在硫酸工业、合成氨工业、硝酸工业中,皆采用循环操作提高原料利用率
C.在氯碱工业,电解槽一般用铁网作电极
D.合成氨工业用天然气造气的方法中,与水蒸汽高温反应优于热分解法
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是周期表的一部分,根据A~I在周期表中的位置,用元素符号或化学式回答问题:
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | |||||
| 3 | B | C | J | F | H | I |
(1)表中元素,化学性质最不活泼的是 _________ ,只有负价而无正价的是 _________ ,可用于制半导体材料的元素是 _________ .
(2)最高价氧化物的水化物碱性最强的物质的电子式是 _________ ,酸性最强的物质是 _________ ,呈两性的物质是 _________ ;
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的化合物是 _________ ;
(4)B元素与A形成的化合物和水反应后溶液呈碱性,同时生成一种可燃气体,写出反应的化学方程式 _________ .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关σ键和π键的说法错误的是 ( )。
A.在某些分子中,化学键可能只有π键而没有σ键
B.当原子形成分子时,首先形成σ键,可能形成π键,配位键都是σ键
C.σ键的特征是轴对称,π键的特征是镜面对称
D.含有π键的分子在反应时,π键是化学反应的积极参与者
查看答案和解析>>
科目:高中化学 来源: 题型:
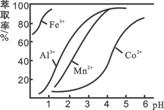
草酸钴用途广泛,可用于指示剂和催化剂制备。一种利用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4·2H2O工艺流程如下:
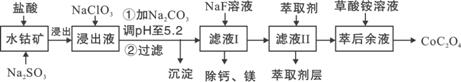 |
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中加入Na2SO3的目的是将_____________还原(填离子符号)。
(2)NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+,产物中氯元素处于最低化合价。该反应的离子方程式为____________。
 (3)请用平衡移动原理分析加Na2CO3能使浸出液中Fe3+、Al3+转化成氢氧化物沉淀的原因:____________________。
(3)请用平衡移动原理分析加Na2CO3能使浸出液中Fe3+、Al3+转化成氢氧化物沉淀的原因:____________________。
(4)萃取剂对金属离子的萃取率与pH的关系如图所示。
滤液Ⅱ中加入萃取剂的作用是_________;使用萃取
剂适宜的pH是______。
A.接近2.0 B.接近3.0 C.接近4.0
(5)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液c(Mg2+)/ c (Ca2+)=____。
查看答案和解析>>
科目:高中化学 来源: 题型:
按要求填空:
(1)(9分)写出下列反应的化学方程式:
①实验室制取氨气 ___________________________________________
②浓硝酸的见光分解_______________________________________
③二氧化氮和水反应_______________________
(2)(10分)A、B、C、D为中学常见物质且均含有同一种元素,相互转化关系如图(反应条件及其他物质已经略去):
A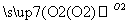 B
B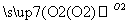 C
C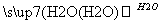 D
D
①若A、B、C、D均为含硫化合物,其中的B具有漂白性,而且它们的水溶液均能使湿润的蓝色石蕊试纸变红,则D为(填写化学式):______。写出B→C的化学方程式:_____________。
②若A是氢化物,其水溶液能使湿润的红色石蕊试纸变蓝,D的稀溶液能使湿润的蓝色石蕊试纸变红。则D的化学式为______。写出A→B的化学方程式: ________________。
③若A为金属单质,组成元素的原子所含质子的数目小于18,D为强碱,写出C→D的化学方程式:___________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com