
| A. | 0.80 mol | B. | 0.72 mol | C. | 0.45 mol | D. | 0.40 mol |
分析 金属铜和稀硫酸之间不会反应,但是可以和稀硝酸之间反应,根据反应:3Cu+2NO3-+8H+=3Cu2++2NO+4H2O来计算.
解答 解:铜不与硫酸反应,但能提供氢离子,硝酸与铜反应,生成硝酸铜,硝酸根离子与硫酸提供的氢离子可以继续反应,反应离子方程式如下:3Cu+2NO3-+8H+=3Cu2++2NO+4H2O,硝酸根离子的浓度与氢离子的浓度比为1:4时,溶解的铜最多,设硫酸的物质的量为xmol,硝酸的物质的量为ymol,则x+y=1.2,$\frac{y}{2x+y}=\frac{1}{4}$,解得x=0.72mol,y=0.48mol,设参加反应的铜的最大物质的量是z,
3Cu+2NO3-+8H+=3Cu2++2NO+4H2O
3 2
z 0.48
$\frac{3}{z}=\frac{2}{0.48}$
解得:z=0.72mol,即理论上最多能溶解铜的物质的量为0.72mol,
故选B.
点评 本题考查学生硝酸的性质知识,注意金属铜和硝酸之间反应,难度不大.


 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:解答题
 +2NaOH=
+2NaOH=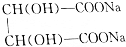 +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有②④⑤ | B. | 只有⑤⑦ | C. | 只有①③⑦ | D. | 只有①② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | H2 A在水中的电离方程式是:H2A=H ++HA -;HA -═H++A2- | |
| B. | 当V(NaOH)=20mL时,则有:c(Na + )>c(HA- )>c(H + )>c(A 2- )>c(OH- ) | |
| C. | 当V(NaOH)=30mL时,则有:2c(H + )+c(HA- )+2c(H2A)=c(A 2- )+2 c(OH- ) | |
| D. | 当V(NaOH)=40mL时,其溶液中水的电离受到抑制 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2Br$→_{水}^{NaOH}$ CH3CH2OH$→_{170℃}^{浓硫酸}$ CH2=CH2$\stackrel{Br_{2}}{→}$ CH2BrCH2Br | |
| B. | CH3CH2Br $\stackrel{HBr}{→}$ CH2BrCH2Br | |
| C. | CH3CH2Br $→_{水}^{NaOH}$ CH2=CH2 CH2BrCH3$\stackrel{HBr_{2}}{→}$CH2BrCH2Br | |
| D. | CH3CH2Br $→_{醇}^{NaOH}$ CH2=CH2$\stackrel{Br_{2}}{→}$ CH2BrCH2Br |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
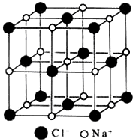
| A. | 在NaCl晶体中,每个Na+周围与其距离最近的Na+有6个 | |
| B. | 氯离子采取A2密堆积,钠离子填入八面体空隙中 | |
| C. | 每个晶胞含2个Na+和2个Cl- | |
| D. | 氯化钠的化学式为NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 、
、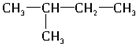 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
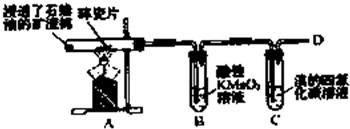 乙烯是石油裂解气的主要成分,下图是石蜡油在炽热碎瓷片的作用下裂解,下列装置检验其性质,完成下列问题.
乙烯是石油裂解气的主要成分,下图是石蜡油在炽热碎瓷片的作用下裂解,下列装置检验其性质,完成下列问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com