
我国制碱工业的先驱——侯德榜先生,1939年发明了著名的侯氏制碱法,其核心反应原理可用如下化学方程式表示:NH3+C02+NaCl+H20=NH4CI+NaHCO3(晶体),依据此原理,欲制得碳酸氢钠晶体,某校学生设计了如下实验装置,其中B装置中的试管内是溶有氨和氯化钠的溶液,且二者均已达到饱和。

(1)A装置中所发生反应的离子方程式为 .
C装置中稀硫酸的作用为
(2)下表中所列出的是相关物质在不同温度下的溶解度数据(g/100 g水);

参照表中数据,请分析B装置中使用冰水的目的是
(3)该校学生在检查完此套装置的气密性后进行实验,结果没有得到碳酸氢钠晶体,指导教师指出
应在 装置之间(填写字母)连接一个盛有 的洗气装置,其作用 。
(4)若该校学生进行实验时,所用饱和食盐水中含NaCl的质量为5.85 g,实验后得到干燥的NaHCO3晶体的质量为5.04 g,则NaHCO3的产率为 。
【知识点】纯碱工业(侯氏制碱法),性质实验方案的设计
【答案解析】(1)CaCO3+2H+=Ca2++CO2↑+H2O (2分);吸收从B装置中的试管内逸出的氨气,减少对环境的污染 (2分) (2)温度越低碳酸氢钠溶解度越小,便于析出(2分)(3)AB,饱和碳酸氢钠溶液;除去二氧化碳气体中的氯化氢气体(2分)(4)60% (2分);
解析:(1)A装置是指取二氧化碳气体的装置,是碳酸钙和盐酸发生反应生成氯化钙、水和二氧化碳;反应的离子方程式为:CaCO3+2H+=Ca2++CO2↑+H2O;C装置稀硫酸是尾气处理装置吸收过量的氨气,防止污染环境;
(2)B装置中的试管内是溶有氨和氯化钠的饱和溶液,通入二氧化碳气体会发生反应生成碳酸氢钠和氯化铵,依据图标分析可知温度越低,碳酸氢钠的溶解度越小,所以温度越低越有利于碳酸氢钠的晶体析出;
(3)二氧化碳气体中含有氯化氢气体,通入后和氨气反应不能生成碳酸氢钠,所以的不到碳酸氢钠晶体,所以需要加一个洗气装置用饱和碳酸氢钠溶液除去二氧化碳中的氯化氢气体;
(4)饱和食盐水中含NaCl的质量为5.85g,依据化学方程式计算NH3+CO2+NaCl+H2O═NH4Cl+NaHCO3(晶体),理论得到碳酸氢钠质量为8.4g:实验后得到干燥的NaHCO3晶体的质量为5.04g,则碳酸氢钠的产率=5.04g/8.4g×100%=60%
【思路点拨】本题考查了侯氏制碱的反应原理和实验设计和操作,流程中注意问题的分析是解题关键,题目难度中等。
.。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
茶叶中铁元素的检验可经以下四个步骤完成,各步骤中选用的实验用品不能都用到的是( )

A.将茶叶灼烧灰化,选用①、②和⑨
B.用浓硝酸溶解茶叶并加蒸馏水稀释,选用④、⑥和⑦
C.过滤得到滤液,选用④、⑤和⑦
D.检验滤液中的Fe3+,选用③、⑧和⑩
查看答案和解析>>
科目:高中化学 来源: 题型:
B.[实验化学]
磷酸铁(FePO4·2H2O,难溶于水的米白色固体)可用于生产药物、食品添加剂和锂离子电池的正极材料。实验室可通过下列实验制备磷酸铁。
(1)称取一定量已除去油污的废铁屑,加入稍过量的稀硫酸,加热、搅拌,反应一段时间后过滤。反应加热的目的是__________________________________。
(2)向滤液中加入一定量H2O2氧化Fe2+。为确定加入H2O2的量,需先用K2Cr2O7标准溶液滴定滤液中的Fe2+,离子方程式如下:
Cr2O +6Fe2++14H+===2Cr3++6Fe3++7H2O
+6Fe2++14H+===2Cr3++6Fe3++7H2O
①在向滴定管中注入K2Cr2O7标准溶液前,滴定管需要检漏、____________________和__________________。
②若滴定x mL滤液中的Fe2+,消耗a mol·L-1 K2Cr2O7标准溶液b mL,则滤液中c(Fe2+)=________mol·L-1。
③为使滤液中的Fe2+完全被H2O2氧化,下列实验条件控制正确的是________(填序号)。
A.加入适当过量的H2O2溶液
B.缓慢滴加H2O2溶液并搅拌
C.加热,使反应在较高温度下进行
D.用氨水调节溶液pH=7
(3)将一定量的Na2HPO4溶液(溶液显碱性)加入到含有Fe3+的溶液中,搅拌、过滤、洗涤、干燥得到FePO4·2H2O。若反应得到的FePO4·2H2O固体呈棕黄色,则磷酸铁中混有的杂质可能为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于Na202的叙述,正确的是 ( )
A.Na202晶体中的阴离子与阳离子的物质的量之比为1:1
B.Na202晶体为离子晶体,且含极性共价键
C.Na202应保存于密封、干燥带玻璃塞的广口瓶中
D.Na202与盐酸反应,不仅有盐和水生成,同时会放出无色气体
查看答案和解析>>
科目:高中化学 来源: 题型:
用惰性电极电解一定量的硫酸铜溶液,实验装置如图1所示。电解过程中的实验数据如图2所示,横坐标表示电解过程中转移电子的物质的量,纵坐标表示电解过程中产生气体的总体积(标况)。则下列说法中正确的是
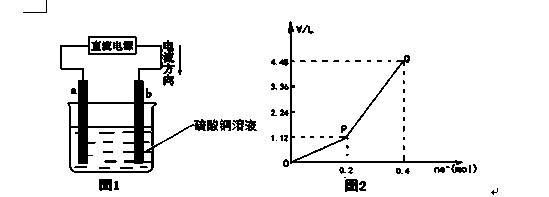
A.电解过程中,b电极表面先有红色物质析出,然后才有气泡产生
B.从开始到Q点时收集到的混合气体的平均相对分子质量为17
C.曲线OP 段表示H2和O2混合气体的体积变化,曲线PQ段表示O2的体积变化
D.a电极上发生反应的方程式为:2H+ + 2e- = H2↑和4OH-–4 e-=2H2O+ O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.需要加热才能发生的反应一定是吸热反应
B.核能、太阳能、生物质能、风能、氢能均属于新能源
C.自发反应的熵一定增大,非自发反应的熵一定减小
D.常温下,反应C(s)+CO2(g) 2CO(g)不能自发进行,则该反应的ΔH>0
2CO(g)不能自发进行,则该反应的ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
在体积为1 L的密闭容器中,进行如下化学反应:
CO2(g)+H2(g) CO(g)+H2O(g),化学平衡常数K与温度T的关系如下表:
CO(g)+H2O(g),化学平衡常数K与温度T的关系如下表:
| T/℃ | 700 | 800 | 850 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的平衡常数表达式K=__________,升高温度,化学平衡向__________
(填“正反应”或“逆反应”)方向移动。
(2)能判断该反应达到化学平衡状态的依据是________。
A.c(CO2)=c(CO) B.K不变 C.容器中的压强不变
D.v正(H2)=v正(CO2) E.c(H2)保持不变
(3)若某温度下,平衡浓度符合下列关系:c(CO2)·c(H2)=c(CO)·c(H2O),此时的温
度为_____;在此温度下,若向该容器中投入1 mol CO2、1.2 mol H2、0.75 mol
CO、1.5 mol H2O,则此时反应朝______方向进行(填“正反应”、“逆反应”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下面是对日常生活中常见的一些做法的解释或现象的描述,其中正确的是
①生产面粉的工厂车间应“严禁烟火”:面粉颗粒很小,悬浮在空气中的单位质量的面粉与O2的接触面积大,遇到明火易发生爆炸
②使用冰箱贮存食物可延长食物保鲜期:冰箱内气温较低,微生物的生长、繁殖速率慢
③镀锡铁桶在镀层破损后破损处很快会出现破洞
④铝比铁性质活泼得多,但铝制品比铁制品耐腐蚀得多:铝表面能形成致密的氧化物保护膜
⑤用酒精擦拭皮肤后,相应部位有清凉感:酒精具有消毒杀菌能力
A.①②③④⑤ B.①②③④ C.①②④ D.③④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com