
| A. | 只有① | B. | ①和② | C. | ①和③ | D. | ①②③ |
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:实验题
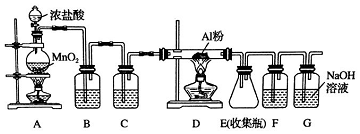
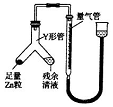
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜片插入硝酸银溶液中:Cu+Ag+=Cu2++Ag | |
| B. | 铁屑在稀H2SO4作用下产生H2Fe+2H+═Fe2++H2↑ | |
| C. | NaHCO3溶液与NaOH溶液反应H++OH-═H2O | |
| D. | H2SO4溶液与Ba(OH)2溶液混合产生沉淀 SO42-+Ba2+═BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol任何气体的体积都约是22.4L | |
| B. | lmolH2和O2的混合气体,在标准状况下的体积约为22.4L | |
| C. | lmol H2气态物质,当体积为22.4L时,该气体一定处于标准状况 | |
| D. | 标准状况下,2molH2O体积约为44.8L |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
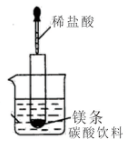 (1)如图所示(夹持仪器省去),把试管放入盛有20℃碳酸饮料的烧杯中,试管中开始放入几块镁条,再用滴管滴加5ml的盐酸于试管中.
(1)如图所示(夹持仪器省去),把试管放入盛有20℃碳酸饮料的烧杯中,试管中开始放入几块镁条,再用滴管滴加5ml的盐酸于试管中.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
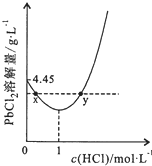 20℃时,PbCl2(s)在不同浓度盐酸中的最大溶解量(单位:g•L-1)如图所示.下列叙述正确的是( )
20℃时,PbCl2(s)在不同浓度盐酸中的最大溶解量(单位:g•L-1)如图所示.下列叙述正确的是( )| A. | 盐酸浓度越大,Ksp(PbCl2)越大 | |
| B. | PbCl2能与一定浓度的盐酸反应 | |
| C. | x、y两点对应的溶液中c(Pb2+)相等 | |
| D. | 往含Pb2+的溶液中加入过量浓盐酸,可将Pb2+完全转化为PbCl2(s) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 共价键 | H-H | N≡N | N-H |
| 键能(kJ•mol-1) | 436 | 945 | 391 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com