

 .
. $→_{△}^{O_{2}/Cu}$Y$→_{Ⅱ}^{一定条件}$乙
$→_{△}^{O_{2}/Cu}$Y$→_{Ⅱ}^{一定条件}$乙 ,设计步骤Ⅰ的目的是保护碳碳双键,防止被氧化.
,设计步骤Ⅰ的目的是保护碳碳双键,防止被氧化. .
. .
. 分析 (1)①羟基、醛基以及碳碳双键都可被高锰酸钾氧化;
②a.苯环上有两个不同的取代基;b.能与Br2的CCl4溶液发生加成反应,说明含有碳碳双键;c.遇FeCl3溶液显呈现紫色说明含有酚羟基;
(2)~(5)甲和氯化氢发生加成反应生成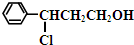 ,
,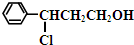 中羟基被氧气氧化生成含有醛基的Y,Y的结构简式为:C6H5CHCl-CH2-CHO,Y发生消去反应生成乙,结合对应有机物的结构和性质解答该题.
中羟基被氧气氧化生成含有醛基的Y,Y的结构简式为:C6H5CHCl-CH2-CHO,Y发生消去反应生成乙,结合对应有机物的结构和性质解答该题.
解答 解:(1)①羟基、醛基以及碳碳双键都可被高锰酸钾氧化,所以不能用高锰酸钾检验碳碳双键,故答案为:不可行;
②a.苯环上有两个不同的取代基;b.能与Br2的CCl4溶液发生加成反应,说明含有碳碳双键;c.遇FeCl3溶液显呈现紫色说明含有酚羟基,则其同分异构体有: 、
、 等,
等,
故答案为: ;
;
(2)甲和氯化氢发生加成反应生成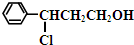 ,
,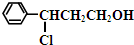 中羟基被氧气氧化生成含有醛基的Y,Y的结构简式为:C6H5CHCl-CH2-CHO,Y发生消去反应生成乙;反应I的反应类型为加成反应,Y的结构简式为:
中羟基被氧气氧化生成含有醛基的Y,Y的结构简式为:C6H5CHCl-CH2-CHO,Y发生消去反应生成乙;反应I的反应类型为加成反应,Y的结构简式为: ,Y发生消去反应生成乙,这样可以保护甲中的碳碳双键,所以设计步骤Ⅰ的目的是保护碳碳双键,防止被氧化,
,Y发生消去反应生成乙,这样可以保护甲中的碳碳双键,所以设计步骤Ⅰ的目的是保护碳碳双键,防止被氧化,
故答案为:加成反应; ;保护碳碳双键,防止被氧化;
;保护碳碳双键,防止被氧化;
(3)乙含有苯环、醛基和碳碳双键,所以1mol乙最多可与 5 mol H2发生加成反应,故答案为:5;
(4)生成Y的化学方程式为 ,
,
故答案为: ;
;
(5)乙与新制Cu(OH)2悬浊液反应的化学方程式为 ,
,
故答案为: .
.
点评 本题考查较为综合,为高考常见题型,涉及有机物推断及合成、有机物的结构与性质、有机反应类型、同分异构体书写等,侧重考查学生的分析能力,注意根据有机物的结构与反应条件进行推断,关键是熟练掌握各种官能团结构和性质,题目难度中等.


 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | X值为2 | B. | 容器内压强不变 | ||
| C. | 平衡时N的浓度为0.6mol/L | D. | M的转化率为80% |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 实验序号 | 起始读数/mL | 终点读数/mL |
| Ⅰ | 2.50 | 22.58 |
| Ⅱ | 1.00 | 23.12 |
| Ⅲ | 0.00 | 19.92 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. |  图甲表示一定温度下FeS和CuS的沉淀溶解平衡曲线,则Ksp(FeS)>Ksp(CuS) | |
| B. |  图乙表示pH=2的甲酸与乙酸溶液稀释时的pH变化曲线,则酸性:甲酸<乙酸 | |
| C. | 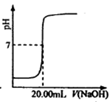 图丙表示用0.1000 mol•L-1NaOH溶液滴定25.00 mL盐酸的滴定曲线,则 c(HCl)=0.0800 mol•L-1 | |
| D. |  图丁表示反应N2(g)+3H2(g)?2NH3(g)平衡时NH3体积分数随起始<“m“:math dsi:zoomscale=150 dsi:_mathzoomed=1>n(N2)n(H2)$\frac{{n(N}_{2})}{n({H}_{2})}$变化的曲线,则转化率:αA(H2)=αB(H2) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 亚硫酸钠固体与硫酸反应制二氧化硫 | |
| B. | 铜与稀硝酸反应制一氧化氮 | |
| C. | 氯化铵与氢氧化钙固体反应制氨气 | |
| D. | 锌和稀硫酸反应制氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 短周期元素是指1~20号元素 | |
| B. | 核素的种类和元素的种类一样多 | |
| C. | 元素周期表中共有18列、16个族 | |
| D. | 主族元素的最高正价均等于其族序数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅晶体是良好的半导体,可用于制造光导纤维 | |
| B. | 高压钠灯发出的黄光透雾能力强,可用于道路和广场照明 | |
| C. | 生石灰能与水反应,可用于除去HC1气体中少量的水蒸气 | |
| D. | 氢氧化钠具有强碱性,可用于制胃酸中和剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硫化锌(ZnS)晶体用作分析试剂、荧光体、光导体材,久置湿空气中易被氧化为ZnSO4.回答下列问题:
硫化锌(ZnS)晶体用作分析试剂、荧光体、光导体材,久置湿空气中易被氧化为ZnSO4.回答下列问题:| ZnF2 | ZnCl2 | ZnBr2 | ZnI2 | |
| 熔点/℃ | 872 | 275 | 394 | 446 |
| 在乙醇、乙醚中溶解性 | 不溶 | 溶解 | 溶解 | 溶解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com