
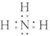 ;
;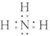 ;
; ,
, ;
; ,
, ;
; ,
, ;
;


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
| A、能使澄清的石灰水变浑浊的气体可能是SO2 |
| B、能使品红溶液褪色将其煮沸溶液又变红的无色气体一定是SO2 |
| C、某强酸性溶液经分析其中含有大量的S2-,SO32- |
| D、用NaHSO3,Na2SO3与浓硫酸反应都可产生SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
70 30 |
208 82 |
277 112 |
1 0 |
| A、上述合成过程中属于化学变化 | ||
| B、Cn元素的相对原子质量为277 | ||
C、
| ||
| D、Cn元素位于元素周期表的第六周期,是副族元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 二氧化氯泡腾片,有效成分(ClO2)是一种高效、安全的杀菌、消毒剂.
二氧化氯泡腾片,有效成分(ClO2)是一种高效、安全的杀菌、消毒剂.| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C3H7Br |
| B、C4H9Br |
| C、C5H11Br |
| D、C6H13Br |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com