
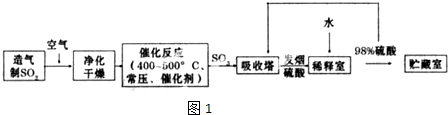
分析 由制备流程可知,二氧化硫与空气发生催化氧化生成三氧化硫,利用发烟硫酸吸收后,利用水稀释得到需要的硫酸,
(1)FeS2的摩尔质量是120g/mol,则4mol的FeS2完全燃烧放出的热量为7.2kJ×120×4=3456kJ,结合物质的状态书写热化学方程式;
(2)催化氧化在接触室进行,净化为了防止催化剂中毒;
(3)温度、压强均影响平衡移动;
(4)据明矾焙烧的化学方程式及元素守恒规律得:4KAl(SO4)2•12H2O~9SO2~9H2SO4,以此计算;
(5)A.氮气不参加反应;
B.氧气浓度增大,反应正向移动;
C.催化剂不影响平衡移动;
D.温度降低会使催化剂的活性降低,反应速率减慢.
解答 解:由制备流程可知,二氧化硫与空气发生催化氧化生成三氧化硫,利用发烟硫酸吸收后,利用水稀释得到需要的硫酸,
(1)FeS2的摩尔质量是120g/mol,则4mol的FeS2完全燃烧放出的热量为7.2kJ×120×4=3456kJ,所以热化学方程式为4FeS2(s)+11O2(g)=2Fe2O3(s)+8SO2(g)△H=-3456kJ/mol,故答案为:4FeS2(s)+11O2(g)=2Fe2O3(s)+8SO2(g)△H=-3456kJ/mol;
(2)二氧化硫转化为三氧化硫在接触室中进行;A处气体中含有杂质易使催化剂中毒,且水蒸气对设备和生产有不良影响,所以在进入接触室之前需净化,
故答案为:接触室;防止催化剂中毒、水蒸气对设备和生产有不良影响;
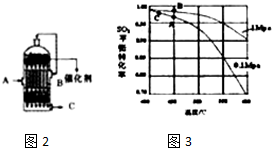
(3)在反应2SO2+O2?2SO3中,SO2转化率较高,工业上一般不采用更高的压强,因为压强越大对设备的投资越大,消耗的动能越大.SO2的转化率在1个大气压下的转化率已达到97%左右,在提高压强,SO2的转化率提高的余地很小;本反应为放热反应,工业生产中不采取较低的温度,因为温度越低,SO2的转化率虽然更高,但催化剂的催化作用会受影响,450℃时,催化剂的催化效率最高,所以选择A点,
故答案为:不选B点,因为压强越大对设备的投资越大,消耗的动能大,二氧化硫原料的转化率在1个大气压时已达97%左右,再提高压强二氧化硫的转化率提高余地很小,所以采用1个大气压;不选C点,因为温度越低,二氧化硫的转化率虽然更高,但是催化剂的催化效率受到影响,450°C时,催化剂的催化效率最高,所以选择A点,不选C点;
(4)根据明矾焙烧的化学方程式及元素守恒规律得:4KAl(SO4)2•12H2O~9SO2~9H2SO4,二氧化硫的利用率为95%,设焙烧711t明矾可生成98%的硫酸质量为x,则
4KAl(SO4)2•12H2O~9H2SO4,
4×474 9×98
711t×95% x×98%
解得x=320.6t,
故答案为:320.6;
(5)A、通入与反应无关的气体,体积不变,压强增大,对平衡无影响,且对反应装置无利,故A错误;
B、向装置中通入氧气且保持体积不变,可以增大氧气的浓度,反应速率加快,平衡正向移动,二氧化硫的转化率提高,对生产有利,故B正确;
C、催化剂只能加快反应速率,不能改变平衡,故C错误;
D、转移SO3减少生成物浓度,平衡正向移动,二氧化硫转化率提高,但温度降低会使催化剂的活性降低,反应速率减慢,对生产不利,故D错误,
故答案为:B.
点评 本题以工业中硫酸的制备为载体考查二氧化硫的催化氧化、化学反应的计算、化学平衡理论的应用等,综合性较强,把握相关反应原理、实验技能为解答的关键,侧重分析与应用能力的考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 乙中C的转化率为20% | |
| B. | Q1+Q2=Q | |
| C. | 达到平衡后,再向乙中加入0.25 molA、0.75molB、1.5molC,平衡向正反应方向移动 | |
| D. | 乙中的热化学反应方程式为2C(g)?A(g)+3B(g);△H=+Q2kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用惰性电极电解MgCl2溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| B. | 向NaClO溶液中滴加少量FeSO4溶液:5ClO-+2Fe2++5H2O═4HClO+Cl-+2Fe(OH)3↓ | |
| C. | 向NH4HCO3稀溶液中滴加过量Ca(OH)2溶液:NH4++HCO3-+2OH-═NH3•H2O+CO32-+H2O | |
| D. | 向CuSO4溶液中滴加过量氨水:Cu2++2 NH3•H2O═Cu(OH)2↓+2 NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在化工生产中应遵循“绿色化学”的思想 | |
| B. | 在元素周期表的过渡元素中寻找优良的催化剂 | |
| C. | 汽车尾气中产生NO的原因是空气中的N2与O2在汽车汽缸内的高温环境下发生反应的产物 | |
| D. | 根据元素周期律,由HClO4可以类推出氟元素也存在最高价氧化物的水化物HFO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴苯中混有溴,加入氢氧化钠溶液,振荡、静置、分液 | |
| B. | 苯中混有苯酚,加浓溴水后过滤 | |
| C. | 乙烷中混有乙烯,通过盛有酸性KMnO4溶液的洗气瓶洗气 | |
| D. | 乙酸乙酯中混有乙酸,可加NaOH溶液,振荡、静置、分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 沸点/℃ | |
| SiHCl3 | 33.0 |
| SiCl4 | 57.6 |
| HCl | -84 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.3mol | B. | 0.4mol | C. | 0.5mol | D. | 0.6mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com