
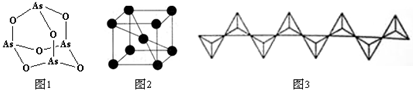
分析 (1)同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素;GaAs 中砷的电负性大于镓,据此判断化合价;
(2)Na3AsO4属于离子化合物,酸根离子中含有共价键;AsO43-中As原子孤电子对数=$\frac{5+3-2×4}{2}$=0、价层电子对数为4+0=4,据此判断空间构型;As4O6的分子中As原子形成3个As-O键,含有1对孤对电子,杂化轨道数目为4;
(3)钒是23号元素,原子核外电子数为23,根据核外电子排布规律书写核外电子排布式;
(4)根据晶胞图可知,每个矾原子周围距离最近的有8个矾原子,每个晶胞中含有的矾原子数为1+8×$\frac{1}{8}$=2,根据$ρ=\frac{\frac{2M}{{N}_{A}}}{V}$可计算出钒的相对原子质量;
(5)由链状结构可知每个V与3个O形成阴离子,且V的化合价为+5价,以此判断形成的化合物的化学式.
解答 解:(1)同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,所以第一电离能As>Ga,GaAs 中砷的电负性大于镓,所以砷显-3价,
故答案为:As;-3;
(2)Na3AsO4属于离子化合物,含有离子键,酸根离子中含有共价键;AsO43-中As原子孤电子对数=$\frac{5+3-2×4}{2}$=0、价层电子对数为4+0=4,空间构型为正四面体;As4O6的分子中As原子形成3个As-O键,含有1对孤对电子,杂化轨道数目为4,杂化类型为sp3杂化,
故答案为:离子键、共价键;正四面体;sp3;
(3)钒是23号元素,原子核外电子数为23,基态原子核外电子排布式为:1s22s22p63s23p63d34s2或[Ar]3d34s2,
故答案为:1s22s22p63s23p63d34s2或[Ar]3d34s2;
(4)根据晶胞图可知,每个矾原子周围距离最近的有8个矾原子,所以矾的配位数为8,每个晶胞中含有的矾原子数为1+8×$\frac{1}{8}$=2,晶胞的体积为d3cm3,根据$ρ=\frac{\frac{2M}{{N}_{A}}}{V}$可知,钒的相对原子质量M=$\frac{1}{2}$ρVNA=$\frac{1}{2}ρ{d}^{3}{N}_{A}$,
故答案为:8;$\frac{1}{2}ρ{d}^{3}{N}_{A}$;
(5)由链状结构可知每个V与3个O形成阴离子,且V的化合价为+5价,则形成的化合物化学式为NaVO3,
故答案为:NaVO3.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、电离能、杂化方式与空间构型判断、化学键、晶胞计算等,是对物质结构主干知识的考查,需要学生具备扎实的基础与灵活运用能力,难度中等,掌握均摊法进行有关晶胞计算.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 聚乙烯塑料的老化是由于发生了加成反应 | |
| B. | 煤经过干馏等物理变化可以转化为清洁燃料 | |
| C. | 煎炸食物的花生油和牛油都属于酯类,属于高分子化合物 | |
| D. | 利用粮食酿酒经过了淀粉→葡萄糖→乙醇的化学变化过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.45 g | B. | 0.54 g | C. | 0.5 g | D. | 0.35 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
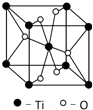 第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物.
第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物.| 元素 | Mn | Fe | |
| 电离能/kJ•mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/s | 0 | 2 | 4 | 6 | 8 |
| n(SO3)/mol | 0 | 0.8 | 1.4 | 1.8 | 1.8 |
| A. | 反应在前2 s 的平均速率v(O2)=0.4 mol•L-1•s-1 | |
| B. | 保持其他条件不变,体积压缩到1.0 L,平衡常数将增大 | |
| C. | 相同温度下,起始时向容器中充入4 mol SO3,达到平衡时,SO3的转化率大于10% | |
| D. | 保持温度不变,向该容器中再充入2 mol SO2、1 mol O2,反应达到新平衡时n(SO3)/n(O2)增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com