
量取10mL碘的饱和水溶液,倒入分液漏斗中,然后再注入4mL四氯化碳,用力振荡后静置,实验现象为
A.液体分层,上层为四氯化碳层,黄色
B.液体分层,上层为水层,紫色
C.液体分层,下层为四氯化碳层,紫色
D.液体分层,下层为水层,黄色
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源:2016届四川省成都市高三上学期期中考试理综化学试卷(解析版) 题型:填空题
(本小题满分14分)
I.H2A在水中存在以下平衡:H2A 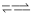 H+ +HA- ,HA
H+ +HA- ,HA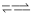 H+ +A2- 。
H+ +A2- 。
(1)NaHA溶液显酸性,则溶液中离子浓度的大小顺序为_____________。
(2)常温时,若向0.1 mol/L的NaHA溶液中逐滴滴加0.1mol/L KOH溶液至溶液呈中性。此时该混合溶液的下列关系中,一定正确的是_____________。
A.c(Na+ )>c(K+ ) B.c(H +)•c(OH )=1×10-14
C.c(Na+ )=c(K+ ) D.c(Na+ )+c(K+ )=c(HA )+c(A2- )
(3)已知常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:
CaA(s) 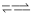 Ca2+ (aq)+A2- (aq)
Ca2+ (aq)+A2- (aq)
滴加少量Na2A固体, c(Ca2+ )_____________(填“增大”、“减小”或“不变”),原因是______________。
Ⅱ.含有Cr2O72- 的废水毒性较大,某工厂废水中含4.00×10-3 mol/L 的Cr2O7 。为使废水能达标排放,作如下处理:
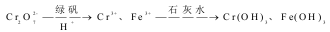
(1)该废水中加入FeSO4·7H2O和稀硫酸,发生反应的离子方程式为:_____________。
(2)欲使25 L该废水中Cr2O7 转化为Cr3+,理论上需要加入_____________g FeSO4·7H2O。
(3)若处理后的废水中残留的 c(Fe )=1×10-13mol/L ,则残留的 Cr3+ 的浓度为____________。(已知:Ksp[Fe(OH)3]≈1.0×10-38mol,/L ,Ksp[Cr(OH)3]≈1.0×10-31 mol/L )
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二上学期10月月考化学试卷(解析版) 题型:选择题
根据反应:S2O32﹣+2H+═SO2+S↓+H2O,下表各组实验最快出现浑浊的是
Na2S2O3溶液 | 稀H2SO4 | H2O | 温度/℃ | |||
c(mol·L﹣1) | V(mL) | c(mol·L﹣1) | V(mL) | V(mL) | ||
A | 0.1 | 5 | 0.1 | 5 | 5 | 10 |
B | 0.2 | 5 | 0.1 | 5 | 10 | 10 |
C | 0.1 | 5 | 0.1 | 5 | 10 | 30 |
D | 0.2 | 5 | 0.1 | 5 | 10 | 30 |
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二上学期第一次月考化学试卷(解析版) 题型:选择题
10 mL某烷烃,在50 mL O2中充分燃烧,得液态水和体积35 mL的混合气体(所有气体体积在同温、同压下测定),则该烃是
A.甲烷 B.乙烷 C.丙烷 D.丁烷
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省黄石市高二上学期10月月考化学试卷(解析版) 题型:选择题
下列关于原电池的叙述正确的是
A.构成原电池的正极和负极必须是两种不同的金属
B.原电池是将化学能转变为电能的装置
C.原电池中电子流出的一极是负极,该极被还原
D.原电池放电时,电流的方向是从负极到正极
查看答案和解析>>
科目:高中化学 来源:2016届江苏省无锡市高三上学期10月月考化学试卷(解析版) 题型:选择题
下列指定反应的离子方程式正确的是
A.Fe2O3溶于HI溶液中:Fe2O3 + 6H+ =2Fe3++ 3H2O
B.[Ag(NH3)2]OH的溶液中加入盐酸:Ag+ + Cl-= AgCl↓
C.Na2S2O3溶液吸收Cl2:4Cl2 + S2O32-+5H2O= 10H+ + 2SO42- + 8Cl-
D.(NH4)2Fe(SO4)2溶液中加入过量NaOH溶液:NH4++ Fe2++3OH-=Fe (OH)2↓+ NH3·H2O
查看答案和解析>>
科目:高中化学 来源:2016届浙江省温州市高三上学期返校联考化学试卷(解析版) 题型:选择题
下列化学用语中,正确的是
A.乙炔的结构简式 CHCH
B.乙醇的比例模型
C.NaCl的电子式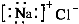
D.S原子结构示意图 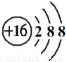
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高一上学期第二次诊断性测试化学试卷(解析版) 题型:填空题
铁是应用最广泛的金属,铁的卤化物也是一种重要化合物。
(1)在实验室中,FeCl2可用铁粉和___________反应制取,FeCl3可用铁粉和___________反应制取。现有含FeCl2和FeCl3的混合物样品,测得n(Fe):n(Cl)=1:2.4,则该样品中FeCl3的物质的量分数为________________。
(2)FeCl2易被氧化,检验一瓶FeCl2溶液是否被氧化的方法(写出操作步骤、现象及结论)是______________。向FeCl2溶液中加入NaOH溶液,开始时生成白色沉淀,后马上变成灰绿色,最终变成红褐色,沉淀变色发生反应的化学方程式为_________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南省高一上第一次联考化学试卷(解析版) 题型:实验题
(11分)下图是我校实验室化学试剂浓硫酸标签上的部分内容。现需要480 mL 1 mol·L-1的稀硫酸。用该浓硫酸和蒸馏水配制,可供选用的仪器有:① 胶头滴管;②玻璃棒;③烧杯;④量筒。

请回答下列问题:
(1)配制稀硫酸时,还缺少的仪器有______________(写仪器名称)。
(2)该硫酸的物质的量浓度为 mol/L;所需浓硫酸的体积 约为___________mL;若将该浓硫酸与等体积的水混合,所得溶液中溶质的质量分数____________49%(填“>” 、“<” 或“=”)。
(3)定容时,若加入的水超过刻度线,必须采取的措施是
(4)下列操作对H2SO4的物质的量浓度有什么影响(偏高、偏低或无影响)?
①转移溶液后,未洗涤烧杯: ;
②容量瓶用水洗净后未烘干: ;
③定容时俯视容量瓶的刻度线: 。
(5)在配置过程中,下列操作不正确的是(填序号) 。
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配液润洗
C.将准确量取的18.4mol·L-1的硫酸,注入已盛有100mL水的500mL的容量瓶中,加水至刻度线.
D.将硫酸溶于水后需冷却至室温再转移到容量瓶中
E.定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手掌托住瓶底,把容量瓶倒转摇匀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com