
煤的“气化”是使煤变成清洁能源的有效途径之一,其主要反应为: C+H2O![]() CO+H2 甲酸苯丙酯(F)是生产香料和药物的重要原料。下面是用煤为原料合成甲酸苯丙酯的路线图(部分反应条件和生成物已略去),其中D的分子式为C9H10O,且能发生银镜反应。
CO+H2 甲酸苯丙酯(F)是生产香料和药物的重要原料。下面是用煤为原料合成甲酸苯丙酯的路线图(部分反应条件和生成物已略去),其中D的分子式为C9H10O,且能发生银镜反应。
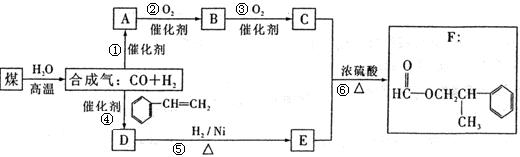
根据上述转化关系回答下列问题:
(1)写出A、D的结构简式:A: ,D: 。
(2)D→E的反应类型为 。
(3)B与新制Cu(OH)2浊液反应也能生成C,写出其化学方程式:
(4)写出C与E反应生成F的化学方程式 。
(5)上图中所标注的6个反应,其中有4个原子利用率达到100%,请写出这4个反应 (填写反应序号)。
(6)F有多种同分异构体,写出满足下列条件的两种同分异构体的结构简式。
①属于酯类,且能发生银镜反应。②苯环上的一氯取代物只有两种结构。③分子结构中只有两个甲基。
、 。
科目:高中化学 来源: 题型:
| c(CH3OH) |
| c(CO)c2(H2) |
| c(CH3OH) |
| c(CO)c2(H2) |
| n(CH3OH) |
| n(CO) |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源:福建省四地六校联考2011届高三第三次月考化学试题 题型:022
A~F是中学常见物质,其中B、D、F均为单质,它们的相互转化关系如下图所示:

(一)若A、C、E是氧化物,构成B、D的元素在同一主族,反应①②都是工业上的重要反应,通过反应②可以实现煤的气化,使煤变为清洁能源.
(1)写出反应①的化学方程式________.
(2)用化学方程式表示E在冶金工业上的一种重要用途________.
(二)若A、C、E是氢化物,构成B和F的元素是第三周期的相邻元素,F是一种淡黄色固体,A能使湿润的红色石蕊试纸变蓝,A、E混合时有白烟生成.
(1)写出D的分子式________.
(2)由A或C转化为E,每消耗1 molB,转移电子的物质的量为________mol.
(3)同温同压下,将V1 L A气体和V2 L E气体通入水中,
①若V1=V2,反应后溶液的pH________7(填“>”或“<”或“=”),原因是________(用离子方程式表示).
②若所得溶液的pH=7,则V1________V2(填“>”或“<”或“=”).
查看答案和解析>>
科目:高中化学 来源:2014届河南省高二第二次阶段考试化学试卷(解析版) 题型:填空题
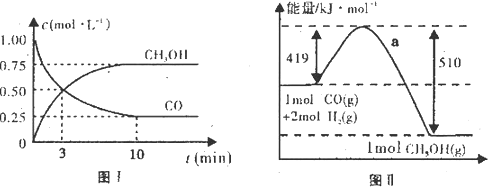
(19分)我国《车用燃料甲醇国家标准》的实施拉开了车用燃料低碳革命的大幕,一些省市正在陆续试点与推广使用甲醇汽油。甲醇可通过将煤的气化过程中生成的CO和H2在一定条件下发生如下反应制得:CO(g) + 2H2(g) 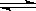 CH3OH(g)。图I、图Ⅱ是关于该反应进行情况的图示。
CH3OH(g)。图I、图Ⅱ是关于该反应进行情况的图示。
请根据图示回答下列问题:
(1)图I是反应时CO和CH3OH的浓度随时间的变化情况,从反应开始到平衡,用CO浓度变化表示平均反应速率v(CO)=_______________。
(2)图Ⅱ表示该反应进行过程中能量的变化,曲线a表示不使用催化剂时反应的能量变化,在图Ⅱ中画出使用催化剂后的能量变化曲线b。
(3)写出该反应的热化学方程式 。
(4)该反应的平衡常数K的表达式为 ;当温度升高时,该平衡常数K将________(填“增大”、“减小”或“不变”)。
(5)恒容条件下,下列措施中能使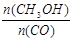 增大的有
。
增大的有
。
A.升高温度 B.充人He气
C.再充入1molCO和2molH2 D.使用催化剂
(6)在恒温条件下,保持CO浓度不变,扩大容器体积,则平衡 (填“逆向移动”、“正向移动”、“不移动”)
(7)在温度、容积相同的三个密闭容器中,按不同方式投料,保持恒温、恒容,测得反应达到平衡时的有关数据如下
|
容器 |
甲 |
乙 |
丙 |
|
投料量 |
1mol CO 、2mol H2 |
1molCH3OH |
2molCH3OH |
|
CH3OH的浓度(mol·L-1) |
c1 |
c2 |
c3 |
|
反应的能量变化 |
放出Q1 kJ |
吸收Q2 kJ |
吸收Q3 kJ |
|
体系压强(Pa) |
P1 |
P2 |
P3 |
|
反应物转化率 |
α1 |
α2 |
α3 |
则下列关系正确的是
A.c1= c2 B.Q3 = 2Q2 C.2 P1<P3
D.α1+α2=1 E.2α2=α3
E.2α2=α3
F.该反应若生成1molCH3OH放出的热量为(Q1+ Q2)kJ
(8)若在一体积可变的密闭容器中充入1mol CO、2mol H2和1molCH3OH,达到平衡时测得混合气体的密度是同温同压下起始的1.6倍,则该反应向 (填“正”、“逆”)反应方向移动,理由是
查看答案和解析>>
科目:高中化学 来源:2011-2012学年山东省高三第二次质量检测化学试卷 题型:填空题
(10分)“低碳循环”已经引起了国民的重视,试回答下列问题:
(1)煤的气化和液化可以提高燃料的利用率。
已知25℃,101 时:
时: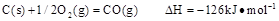
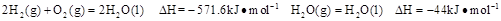
则在25℃,101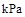 时:
时: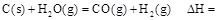 .
.
(2)高炉炼铁是CO气体的重要用途之一,其基本反应为:
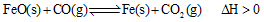 ,已知在1100℃时,该反应的化学平衡常数K=0.263。
,已知在1100℃时,该反应的化学平衡常数K=0.263。
①温度升高,化学平衡移动后达到新的平衡,此时平衡常数K值 (填“增大”、“减小”或“不变”);
②1100℃时测得高炉时,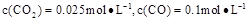 ,在这种情况下,该反应是否处于化学平衡状态? (填“是”或“否”),其判断依据是
。
,在这种情况下,该反应是否处于化学平衡状态? (填“是”或“否”),其判断依据是
。
③目前工业上可用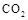 来生产燃料甲醇,有关反应为:
来生产燃料甲醇,有关反应为:
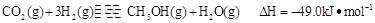 。现向体积为1L的密闭容器中,充入1mol
。现向体积为1L的密闭容器中,充入1mol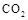 和3mol
和3mol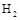 ,反应过程中测得
,反应过程中测得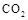 和
和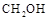 (g)的浓度随时间的变化如图所示。
(g)的浓度随时间的变化如图所示。
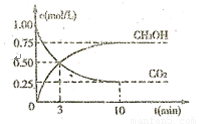
①从反应开始到平衡,氢气的平均反应速率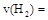 ;[来源:]
;[来源:]
②下列措施能使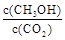 增大的是 (填符号)。
增大的是 (填符号)。
A.升高温度 B.再充入 C.再充入
C.再充入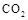
D.将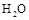 (g)从体系中分离
E.充入He(g),使体系压强增大
(g)从体系中分离
E.充入He(g),使体系压强增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com