
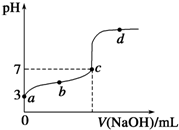
 已知某温度时CH3COOH的电离平衡常数为K.该温度下向20mL 0.1mol/L CH3COOH溶液中逐滴加入0.1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中正确的是( )
已知某温度时CH3COOH的电离平衡常数为K.该温度下向20mL 0.1mol/L CH3COOH溶液中逐滴加入0.1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中正确的是( )| A、a点表示溶液中c(CH3COO-)约为10-3 mol/L | ||
| B、b点表示的溶液中c(Na+)>c(CH3COO-) | ||
| C、c点表示CH3COOH和NaOH恰好反应完全 | ||
D、d点表示的溶液中
|
| c(CH3COO-)?c(H+) |
| c(CH3COOH) |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 编号 | 往烧杯中加入的试剂及其用量(mL) | 催化剂 | 溶液开始变蓝时间(min) | ||||
| 0.1 mol?L-1 KI溶液 |
H2O | 0.01 mol?L-1 X 溶液 |
0.1 mol?L-1 双氧水 |
1 mol?L-1 稀盐酸 | |||
| 1 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 无 | 1.4 |
| 2 | 20.0 | m | 10.0 | 10.0 | n | 无 | 2.8 |
| 3 | 10.0 | 20.0 | 10.0 | 20.0 | 20.0 | 无 | 2.8 |
| 4 | 20.0 | 0 | 10.0 | 10.0 | 40.0 | 无 | t |
| 5 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 5滴Fe2(SO4)3 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、放电时负极附近溶液的pH不变 |
| B、放电时电解质溶液中的OH-向正极移动 |
| C、充电时电池的负极应与电源的负极相连接 |
| D、充电时阳极反应:Ni(OH)2-e-+OH-=NiOOH+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、升高温度 |
| B、增大压强 |
| C、增大H2的浓度 |
| D、使用催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实 验 内 容 | 实 验 目 的 | |
| A | 将SO2通入酸性KMnO4溶液中 | 证明SO2的水溶液具有弱酸性 |
| B | 将饱和的FeCl3溶液滴到沸水中 | 促进Fe3+水解,制得Fe(OH)3胶体 |
| C | 在淀粉KI溶液中滴加少量市售食盐配制的溶液 | 真假碘盐的鉴别 |
| D | 在少量Fe(NO3)2试样加水溶解的溶液中,滴加稀H2SO4酸化,再滴加KSCN溶液 | 检验Fe(NO3)2试样是否变质 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、强酸性溶液中:K+、Al3+、CH3COO-、SO42- | ||
B、水电离出来的c(H+)=10-13mol/L的溶液:K+、HCO
| ||
| C、室温下,pH=1的无色溶液中:NH4+、Mg2+、SO42-、Cl- | ||
| D、室温下,pH=1的溶液中:Na+、Fe2+、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4Cl溶液中:c(NH4+)>c(Cl-)>c(H+)>c(OH-) | ||||
B、NaHSO3溶液(呈酸性)中:c(Na+)>c(HSO
| ||||
| C、CH3COONa溶液中:c(Na+)+c(H+)=c(CH3COO-)+c(OH-) | ||||
D、Na2CO3溶液中:2c(Na+)=c(CO
|
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com