
【题目】二甲醚(CH3OCH3)是一种新兴化工原料,具有甲基化反应性能。
I.二甲醚的生产:二甲醚的生产原理之一是利用甲醇脱水成二甲醚,化学方程式如下:
反应i 2CH3OH(g) ![]() CH3OCH3(g) + H2O(g) ΔH 1
CH3OCH3(g) + H2O(g) ΔH 1
(1)已知:甲醇、二甲醚的气态标准燃烧热分别为-761.5 kJ·mol-1、-1455.2 kJ·mol-1,且H2O(g) = H2O(l) ΔH=﹣44.0 kJ·mol﹣1。则反应i的ΔH 1=_________kJ·mol﹣1.
(2)反应i中甲醇转化率、二甲醚选择性的百分率与不同催化剂的关系如下表所示,生产时,选择的最佳催化剂是_________。
催化剂 | 甲醇转化率/% | 二甲醚选择性/% |
SiO2-TiO2/SO42- | 35.1 | 98.1 |
SiO2-TiO2/Fe3+ | 52.9 | 98.7 |
GSAL-108 | 81.0 | 98.1 |
SiO2-Al2O3 | 62.1 | 96.4 |
注:反应条件:常压、温度270℃,甲醇液体空速14mL/(g·h)
(3)选定催化剂后,测得平衡时的甲醇转化率与温度的关系如图所示。经研究产物的典型色谱图发现该过程主要存在的副反应为:
反应ii 2CH3OH(g) ![]() C2H4 (g)+2H2O(g) ΔH2=﹣29.1kJ·mol﹣1
C2H4 (g)+2H2O(g) ΔH2=﹣29.1kJ·mol﹣1
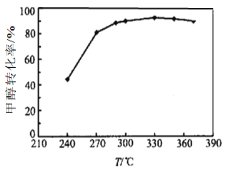
① 工业上生产二甲醚的温度通常在270-300℃,高于330℃之后,甲醇转化率下降。
根据化学平衡移动原理分析其原因可能是_________;
根据化学反应速率变化分析其原因可能是_________。
② 某温度下,以CH3OH(g)为原料,平衡时各物质的分压数据如下表:
物质 | CH3OH(g) | CH3OCH3(g) | C2H4 (g) | H2O(g) |
分压/MPa | 0.16 | 0.288 | 0.016 | … |
则反应i中,CH3OH(g)的平衡转化率α=_________。(用平衡分压代替平衡浓度计算;结果保留两位有效数字。)
II.二甲醚的应用:
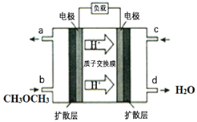
(4)下图为绿色电源“直接二甲醚燃料电池”的工作原理示意图。该电池的负极反应式为:_________;
【答案】﹣23.8 GSAL-108 该反应是放热反应,温度升高,平衡逆向移动,转化率下降 温度升高,催化剂活性降低,对二甲醚的选择性下降,转化率下降 75% CH3OCH3﹣12e﹣+3H2O=2CO2+12H+
【解析】
(1)根据甲醇、二甲醚的气态标准燃烧热写出热化学方程式,再根据盖斯定律书写出目标方程式;
(2)甲醇的转化率越大、二甲醚的选择性越高越好;
(3)①升高温度平衡向吸热方向移动;催化剂活性在一定温度范围内,当不在该范围内时催化剂会失去活性;②同一容器中,不同物质的压强之比等于其物质的量之比分析解答;
(4)①根据溶液中氢离子的移动方向可知,左电极为负极,负极上二甲醚失电子生成二氧化碳和氢离子,据此书写电极反应式。
I.(1)甲醇、二甲醚的气态标准燃烧热分别为-761.5kJmol-1、-1455.2kJmol-1,其热化学方程式分别为:①CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(l) △H=-761.5kJmol-1,②CH3OCH3(g)+3O2(g) = 2CO2(g)+3H2O(l) △H=-1455.2kJmol-1,③H2O(g)=H2O(1) △H=-44.0kJmol-1,根据盖斯定律,将方程式①×2-②-③得:2CH3OH(g)CH3OCH3(g)+H2O(g) △H=[2×(-761.5)+1455.2+44.0]kJ/mol=-23.8kJ/mol,故答案为:-23.8;
O2(g)=CO2(g)+2H2O(l) △H=-761.5kJmol-1,②CH3OCH3(g)+3O2(g) = 2CO2(g)+3H2O(l) △H=-1455.2kJmol-1,③H2O(g)=H2O(1) △H=-44.0kJmol-1,根据盖斯定律,将方程式①×2-②-③得:2CH3OH(g)CH3OCH3(g)+H2O(g) △H=[2×(-761.5)+1455.2+44.0]kJ/mol=-23.8kJ/mol,故答案为:-23.8;
(2)甲醇的转化率越大、二甲醚的选择性越高越好,根据表中数据知,应该选取催化剂GSAL-108,故答案为:GSAL-108;
(3)①升高温度平衡向吸热方向移动,该反应的正反应是放热反应,升高温度平衡逆向移动,转化率下降;温度升高催化剂失活,对二甲醚选择性下降,转化率下降,故答案为:该反应的正反应是放热反应,升高温度平衡逆向移动,转化率下降;温度升高催化剂失活,对二甲醚选择性下降,转化率下降;
②同一容器中,不同物质的压强之比等于其物质的量之比,根据分压中甲醇、二甲醚、乙烯的物质的量之比=0.16MPa∶0.288MPa∶0.016MPa=10∶18∶1,假设平衡时甲醇、二甲醚、乙烯的物质的量分别是10mol、18mol、1mol,根据C原子守恒知,生成18mol二甲醚需要36mol甲醇、生成1mol乙烯需要2mol甲醇,则开始时甲醇物质的量=(10+36+2)mol=48mol,反应i中甲醇的转化率=![]() ×100%=
×100%=![]() ×100%=75%,故答案为:75%;
×100%=75%,故答案为:75%;
II.(4)根据溶液中氢离子的移动方向可知,左电极为负极,负极上二甲醚失电子生成二氧化碳和氢离子,负极反应式为:(CH3)2O-12e-+3H2O=2CO2+12H+,右电极为正极,正极上氧气得电子和氢离子反应生成水,正极的反应式为O2 + 4e-- + 4H+ == 2H2O,故答案为:(CH3)2O-12e-+3H2O=2CO2+12H+。


科目:高中化学 来源: 题型:
【题目】丙烷的分子结构可简写成键线式结构![]() ,有机物A的键线式结构为
,有机物A的键线式结构为![]() ,有机物B与等物质的量的H2发生加成反应可得到有机物A。下列有关说法错误的是( )
,有机物B与等物质的量的H2发生加成反应可得到有机物A。下列有关说法错误的是( )
A. B的结构可能有3种,其中一种名称为2,2,3-三甲基-2-戊烯
B. 用系统命名法命名有机物A,名称为2,2,3-三甲基戊烷
C. 有机物A的分子式为C8H18
D. 有机物A的一氯取代物只有5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式与所述事实相符且正确的是
A.铁粉与过量稀盐酸反应:2Fe+6H+![]() 2Fe3++3H2↑
2Fe3++3H2↑
B.用Ca(OH)2与NH4Cl固体混合共热制取少量氨气:OH-+NH4+![]() NH3↑+H2O
NH3↑+H2O
C.铝与NaOH溶液反应:Al+2OH-= AlO2-+ H2↑
D.NO2溶于水:3NO2+H2O![]() 2H++ 2NO3-+ NO
2H++ 2NO3-+ NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g) + O2(g) ![]() 2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。下列判断中,正确的是
2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。下列判断中,正确的是
甲 | 乙 | 丙 | ||
起始物质的量 | n(SO2) / mol | 0.4 | 0.8 | 0.8 |
n(O2) / mol | 0.24 | 0.24 | 0.48 | |
SO2的平衡转化率 / % | 80 | α1 | α2 | |
A. 甲中反应的平衡常数小于乙
B. 平衡时,丙中c(SO3)是甲中的2倍
C. 该温度下,平衡常数值为400
D. 平衡时,甲中O2的转化率大于乙中O2的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO 还原脱硝技术可有效降低烟气中的NOx的排放量。回答下列问题:
I.CO 还原NO 的脱硝反应:2CO(g)+2NO(g) ![]() 2CO2(g)+N2(g) △H
2CO2(g)+N2(g) △H
(1)汽车在行驶过程中会产生有害气体CO、NO,它们之间能发生上述反应:
① 该反应平衡常数K表达式为_________;
② 该反应的K极大(570 K时为1×1059),但汽车上仍需装备尾气处理装置,其可能原因是_______;
(2)以Mn3O4 为脱硝反应的催化剂,研究者提出如下反应历程,将历程补充完整。
第一步:_________;
第二步:3MnO2+2CO=Mn3O4+2CO2
(3)在恒温恒容的密闭容器中,充入等物质的量的CO 和NO 混合气体,加入Mn3O4 发生脱硝反应,t0 时达到平衡,测得反应过程中CO2 的体积分数与时间的关系如右图所示。
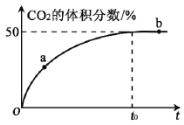
① 比较大小:a处v正______b处v逆(填“>”、“<”或“=”)
② NO 的平衡转化率为_______。
II.T℃时,在刚性反应器中发生如下反应:CO(g)+NO2(g) ![]() CO2(g)+NO(g),化学反应速率v =kPm(CO)Pn( NO2),k 为化学反应速率常数。研究表明,该温度下反应物的分压与化学反应速率的关系如下表所示:
CO2(g)+NO(g),化学反应速率v =kPm(CO)Pn( NO2),k 为化学反应速率常数。研究表明,该温度下反应物的分压与化学反应速率的关系如下表所示:
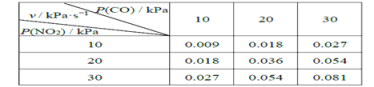
(4)若反应初始时P(CO)=P(NO2)=a kPa,反应t min时达到平衡,测得体系中P(NO)=b kPa,则此时v=_________kPa·s-1(用含有a和b的代数式表示,下同),该反应的化学平衡常数Kp=_________(Kp是以分压表示的平衡常数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苹果酸的结构简式为![]() ,下列说法错误的是( )
,下列说法错误的是( )
A.1mol苹果酸可与2molNaOH发生中和反应
B.一定条件下,苹果酸与乙酸或乙醇均能发生酯化反应
C.![]() 与苹果酸互为同分异构体
与苹果酸互为同分异构体
D.1mol苹果酸与足量金属Na反应生成1.5molH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向CuSO4溶液中加入H2O2溶液,很快有大量气体逸出,同时放热,一段时间后,蓝色溶液变为红色浑浊(Cu2O),继续加入H2O2溶液,红色浑浊又变为蓝色溶液,这个反应可以反复多次。下列关于上述过程的说法不正确的是
A. Cu2+是H2O2分解反应的催化剂 B. H2O2只表现了氧化性
C. H2O2的电子式为: ![]() D. 发生了反应Cu2O + H2O2+4H+=2Cu2++3H2O
D. 发生了反应Cu2O + H2O2+4H+=2Cu2++3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如下图所示。下列说法正确的是 ( )
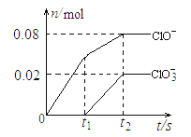
A.苛性钾溶液中KOH的质量是15.68 g
B.反应中ClO3-的生成是因为Cl2通入过量
C.在酸性条件下 ClO- 和ClO3-可生成Cl2
D.一定有3.136 L氯气参与反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有化合物,甲:![]() 乙:
乙:![]() 丙:
丙:![]()
(1)甲、乙、丙之间是否互为同分异构体 ____(填“是”、“否”)请写出丙中含氧官能团的称:_______。
(2)写出只有一个侧链并且能水解的甲的同分异构体:___________
(3)请分别写出鉴别甲、乙、丙化合物的方法(指明所选试剂及主要现象即可)。
鉴别甲的方法:______________。
鉴别乙的方法:_____________________。
鉴别丙的方法:______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com