
【题目】镁-空气电池是一种新型燃料电池,其工作原理如图所示。下列说法错误的是( )

A.金属Mg电极为负极,其电势低于空气电极的电势
B.电子流向:Mg电极→导线→空气电极→电解质溶液→Mg电极
C.电池总反应为2Mg+O2+2H2O=2Mg(OH)2
D.回收后的氢氧化镁经一系列转化,可重新制成镁锭循环利用
科目:高中化学 来源: 题型:
【题目】已知合成氨反应N2(g)+ 3H2(g) ![]() 2NH3(g) △H<0,当反应器中按n(N2): n(H2)=1:3投料后,在不同温度下,反应达到平衡时,得到混合物中NH3的物质的量分数随压强的变化曲线a,b,c如下图所示。下列说法正确的是( )
2NH3(g) △H<0,当反应器中按n(N2): n(H2)=1:3投料后,在不同温度下,反应达到平衡时,得到混合物中NH3的物质的量分数随压强的变化曲线a,b,c如下图所示。下列说法正确的是( )

A. 曲线a对应的反应温度最高
B. 上图中M、N、Q点平衡常数K的大小关系为K(M)=K(Q)<K(N)
C. 相同压强下,投料相同,达到平衡所需时间关系为c>b>a
D. N点时 c(NN3)=0.2 mol/L,则 N点的c(N2): c(NH3)=1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上高纯硅可以通过下列反应制取:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g)-236kJ,完成下列填空:
Si(s)+4HCl(g)-236kJ,完成下列填空:
(1)在一定温度下进行上述反应,若反应容器的容积为 2L,经 3min 后达到平衡,获得固体的质量 8.4 g,则用 H2 表示的平均反应速率为_________。
(2)该反应的平衡常数表达式 K=_________,若欲使 K 增大,可采取的措施是_________。
(3)一定条件下,在密闭恒容容器中,能表示上述反应一定达到化学平衡状态的是_________。
a.2v 逆(SiCl4)=v 正(H2) b.断开 4mol Si-Cl 键的同时,生成 4mol H-Cl 键
c.混合气体密度保持不变 d.c(SiCl4):c(H2):c(HCl)=1:2:4
(4)若反应过程如图所示,纵坐标表示氢气、氯化氢的物质的量(mol),横坐标表示时间(min),若整个反应过程没有加入或提取各物质,则第 1.5 分钟v(正) ____ v(逆)(填><或=),第 3 分钟改变的条件是_______,各平衡态中氢气转化率最小的时间段是_______。
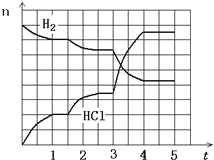
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,其中的编号代表对应的元素。

请回答:
(1)在周期表给出的10种元素中,电负性最小的元素基态原子的电子排布式为_____。
(2)在周期表给出的10种元素中,最外层未成对电子数与最外层成对电子数的个数比为3:2的元素与短周期最外层没有未成对电子数的元素形成的化合物是______(填化学式),所含化学键类型是_________。
(3)关于元素①与元素⑤形成的1:1的化合物,下列说法正确的是_____(填字母序号)。
A.该化合物中的所有原子都满足最外层8电子稳定结构
B.该化合物分子中σ键和π键数目比为1:1
C.该化合物是由极性键和非极性键形成的极性分子
D.该化合物分子的空间构型为直线形
(4)在①与③形成的相对分子质量最小的化合物A中,元素③的杂化类型是_____,写出与化合物A互为等电子体的一种阳离子_______(填离子符号)。
(5)元素⑧的+3价化合物MCl3·6H2O有三种不同颜色的异构体,为探究MCl3溶液析出的暗绿色晶体的化学式,取0.010molMCl3·6H2O配成溶液,滴加足量AgNO3溶液,得到沉淀2.870g,该晶体的化学式为_______(填字母序号)。
A.[M(H2O)6]Cl3 B.[M(H2O)5Cl]Cl2·H2O C.[M(H2O)4Cl2]Cl·2H2O
(6)元素⑩与元素⑤形成一种化合物其晶胞结构如下图所示,该化合物的化学式为____,若该晶体密度为dg/cm3,晶胞参数为apm,则阿伏加德罗常数的值NA为______。
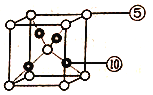
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化铍(BeO)常温下为不溶于水、易溶于强酸和强碱的固体,除用作耐火材料外,还可以用于制霓虹灯和铍合金。工业上以硅铍石(主要含有BeO、SiO2、MgO,还含有少量Al2O3和Fe2O3)制备高纯度BeO的流程如图所示:

已知:①BeO为离子化合物,熔点为2350℃,BeC12和NaC1等比例混合的固体混合物在350℃即可熔化;
②不同金属阳离子在D2EHPA中的溶解性如下表所示:
Be2+ | Mg2+ | Fe3+ | Al3+ | |
D2EHPA中的溶解性 | 易溶 | 难溶 | 微溶 | 微溶 |
请回答下列问题:
(1)“滤渣1”的主要成分为__(填化学式)。“残液”中含量最多的金属元素为__(填名称)。
(2)“萃取”后铍元素以Be(HX2)2的形式存在于有机相中,“反萃取”后以(NH4)2Be(CO3)2的形式存在于水相中,则“反萃取”时含铍微粒发生反应的化学方程式为___。
(3)“净化”时需将反萃取液加热到70℃,加热到70℃的目的为__。
(4)由2BeCO3·Be(OH)2制备高纯BeO的方法是__。
(5)BeO的电子式为__。工业上常采用电解熔融BeC12与NaC1等比例混合物的方法制备金属Be,不采用电解熔融BeO制备的主要原因为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯元素是中学化学中常见的重要非金属元素之一,氯元素的单质及其化合物在生产与生活中有着重要的用途,依据所学知识完成下列问题:
Ⅰ.实验室制备氯气的化学方程式是_____________________;多余的氯气用氢氧化钠溶液吸收,其离子方程式为_________________
Ⅱ.常温下,二氧化氯(ClO2)是一种黄绿色气体,具有强氧化性,已被联合国世界卫生组织(WHO)列为高效安全消毒剂。常温下,它可用氯酸钠固体与浓盐酸反应制备得到,还有 NaCl与C12生成。
(1)写出并配平该反应的化学方程式____________________。
(2)如果反应中生成标准状况下11.2L 氯气,则被氧化的 HCl的物质的量为_______,转移电子数为_________。
(3)二氧化氯可迅速氧化硫化物(其中还原产物中氯元素为负一价),以除去水中硫化物产生的臭味。取适量ClO2,通入到含有H2S(二元弱酸)的水中,再向共中加入少量氯化钡溶液,发现有白色沉淀生成。写出ClO2与H2S水溶液反应的离子方程式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常利用CO2和NH3合成尿素[CO(NH2)2],该可逆反应分两步进行,整个过程中的能量变化如图所示。下列说法错误的是( )
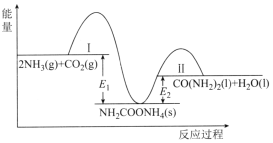
A.NH2COONH4为合成尿素反应的中间产物
B.反应Ⅰ逆反应的活化能>反应Ⅱ正反应的活化能
C.反应Ⅱ在热力学上进行趋势很大
D.2NH3(g)+CO2(g)![]() CO(NH2)2(1)+H2O(1)的焓变△H=El-E2
CO(NH2)2(1)+H2O(1)的焓变△H=El-E2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是无机物A到M在一定条件下的转化关系(部分产物及反应条件未列出)。其中, I 是由第三周期元素组成的单质中,熔点最高的金属。K是一种红棕色气体。

请回答下列问题
(1)M、F、E、G 四种物质中所含同一种元素,其名称是_____________。
(2)写出反应⑩(溶液 J + G)的离子反应方程式__________________________________。
(3)反应④中被还原的离子和被氧化的离子的物质的量之比是___________。
(4)向M的溶液中直接滴加 NaOH 溶液,现象是______________________,写出相应的化学方程式_____________________________,_______________________________。
(5)将化合物 D 与 KNO3、KOH 共融,可制得一种“绿色”环保高效净水剂 K2FeO4(高铁酸钾),同时还生成 KNO2 和 H2O 。该反应的的化学方程式是___________________________。
(6)共有120 t 硫铁矿(FeS2)参与反应①冶炼化合物D,最终得到化合物D共16 t,则冶炼D的转化率为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示。
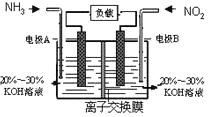
下列说法不正确的是
A. 电流从右侧电极经过负载后流向左侧电极
B. 为使电池持续放电,离子交换膜需选用阴离子交换膜
C. 电极A极反应式为:2NH3-6e-=N2+6H+
D. 当有4.48LNO2(标准状况) 被处理时,转移电子为0.8mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com