
| A. | 加入过量Na2CO3溶液:Na+、Ca2+、NH4+、NO3-、H+ | |
| B. | 加入适量NaHCO3溶液:Na+、Ca2+、NH4+、NO3-、HCO3- | |
| C. | 加入适量NaOH溶液:Na+、Ca2+、NH4+、NO3-、OH- | |
| D. | 加入过量FeSO4和稀硫酸:Fe2+、Fe3+、NH4+、Ca2+、NO3- |
分析 根据离子之间不能结合生成沉淀、气体、水等,不能发生氧化还原反应等,则离子大量共存,以此来解答.
解答 解:A.加入过量Na2CO3溶液与H+、Ca2+反应生成气体、沉淀,不能共存,故A不选;
B.加入适量NaHCO3溶液,该组离子之间不反应,可大量共存,故B选;
C.加入适量NaOH溶液,与NH4+反应不能共存,故C不选;
D.加入过量FeSO4和稀硫酸,Fe2+、H+、NO3-发生氧化还原反应,且Ca2+、SO42-结合生成沉淀,不能共存,故D不选;
故选B.
点评 本题考查离子的共存,为高频考点,把握常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应、氧化后还原反应的判断,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 氮及其化合物在工业生产和国防建设中有广泛应用.回答下列问题:
氮及其化合物在工业生产和国防建设中有广泛应用.回答下列问题: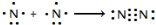 .
.| 化学键 | N-H | N-N | N═N | N≡N | O═O | O-H |
| 键能(kJ/mol) | 390.8 | 193 | 418 | 946 | 497.3 | 462.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有可逆反应:Fe(s)+CO2(g)?FeO(s)+CO(g).已知938K时平衡常数K=1.47,1173K时平衡常数K=2.15.
有可逆反应:Fe(s)+CO2(g)?FeO(s)+CO(g).已知938K时平衡常数K=1.47,1173K时平衡常数K=2.15.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
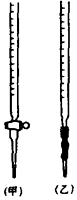 已知KMnO4、MnO2在酸性条件下均能将草酸 (H2C2O4)氧化:
已知KMnO4、MnO2在酸性条件下均能将草酸 (H2C2O4)氧化:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com