
【题目】以乙炔为原料通过以下流程能合成有机物中间体D。

已知:(1)
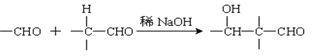
(2):
请回答下列问题:
(1)化合物A的分子式为___________,1mol A完全燃烧需要消耗_____mol氧气。
(2)反应②的反应类型是:______________;化合物B的名称是:____________。
(3)写出①反应的化学方程式_________________________________________________。
(4)已知1mol HCHO和1mol CH3CH2CHO发生类似已知(2)的反应,生成1molE。写出E的结构简式为:_____________________。
【答案】C4H6O2 4.5 加成反应 1,4—丁二醇 HC≡CH+2HCHO![]() HOCH2C≡CCH2OH
HOCH2C≡CCH2OH ![]()
【解析】
乙炔和甲醛发生加成反应生成A,A与足量氢气反应生成B为HOCH2CH2CH2CH2OH,B发生氧化反应生成C,C为OHCCH2CH2CHO,C发生信息(2)的反应生成D,1mol HCHO和1mol CH3CH2CHO发生类似已知(2)的反应,生成1molE,E为HOCH2CH(CH3)CHO,结合对应的物质的性质以及题目要求解答该题。
根据上述分析可知,则
(1)A的结构简式为HOCH2C≡CCH2OH,则分子式为:C4H6O2,1mol A完全燃烧需要消耗氧气的物质的量为4+![]() -
-![]() = 4.5 mol,
= 4.5 mol,
故答案为:C4H6O2;4.5;
(2)反应②加入足量氢气,碳碳三键变为碳碳单键,反应类型为加成反应生成B为HOCH2CH2CH2CH2OH,其名称为1,4—丁二醇,
故答案为:加成反应;1,4—丁二醇;
(3)根据已知信息可知,乙炔与甲醛反应生成HOCH2C≡CCH2OH 的化学方程式为:HC≡CH+2HCHO![]() HOCH2C≡CCH2OH,
HOCH2C≡CCH2OH,
故答案为:HC≡CH+2HCHO![]() HOCH2C≡CCH2OH;
HOCH2C≡CCH2OH;
(4)根据已知给定反应(2),可知1mol HCHO和1mol CH3CH2CHO在稀氢氧化钠溶液条件下反应可生成1mol![]() ,则E为
,则E为![]() ,
,
故答案为:![]() 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】图1是铜锌原电池示意图。图2中,x轴表示实验时流入正极的电子的物质的量,y轴表示( )
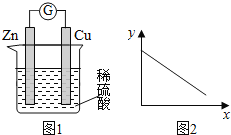
A. 铜棒的质量 B. c(Zn2+) C. c(H+) D. c(SO42-) -
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物I(C11H12O3)是制备液晶材料的中间体之一,其分子中含有醛基和酯基,I可以用E和H在一定条件下合成:
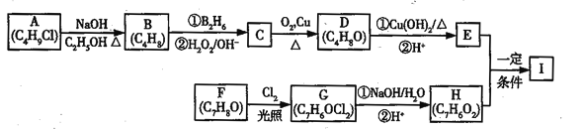
已知以下信息:
①A的核磁共振氢谱表明其只有一种化学环境的氢;
②R﹣CH=CH2![]() R﹣CH2CH2OH;
R﹣CH2CH2OH;
③化合物F苯环上的一氯代物只有两种;
④通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。
回答下列问题:
(1)A的化学名称为_______________________________;
(2)D的结构简式为_______________________________;
(3)E中的官能团名称为___________________________;
(4)F生成G的化学方程式为__________________________,该反应类型为______________;
(5)I的结构简式为_________________________________。
(6)I的同系物J比I相对分子质量小14,J的同分异构体中能同时满足如下条件:①苯环上只有两个取代基,②既能发生银镜反应,又能与饱和NaHCO3溶液反应放出CO2,共有____种(不考虑立体异构)。J的一个同分异构体发生银镜反应并酸化后核磁共振氢谱为三组峰,且峰面积比为2:2:1,写出J的这种同分异构体的结构简式________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积固定的密闭容器中发生反应:![]() 。下列叙述中不能说明上述反应已达到化学平衡状态的是
。下列叙述中不能说明上述反应已达到化学平衡状态的是
A.混合气体的密度不变
B.体系的压强不变
C.混合气体的平均相对分子质量不变
D.反应体系中乙醇的物质的量浓度不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表是学习物质结构和性质的重要工具,下面是元素周期表的一部分,表中所列字母A、D、E、G、Q、M、R分别代表某一化学元素。请用所给元素回答下列问题。
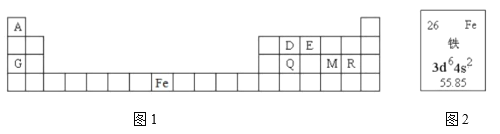
(1)表中某元素原子的核外电子层数是最外层电子数的3倍,该元素的原子结构示意图为_____________。R原子的最外层电子排布式____________________________;原子核外有________种能量不同的电子。R原子最外层有________种运动状态不同的电子。
(2)元素Fe在元素周期表中的位置是__________________________________________。图2中,55.85表示__________________________________________________________。
(3)表中某些元素的原子可形成与Ar具有相同电子层结构的简单离子,这些离子的半径由大到小的顺序是____________________(填离子符号)。
(4)M、D两种元素形成的化合物含有的化学键类型是____________________(填“极性键”或“非极性键”),其分子是____________________(填“极性分子”或“非极性分子”)。D、Q的最高价氧化物形成的晶体相比,熔点较高的是____________________(用化学式表示)。
(5)表中金属性最强的元素与铝元素相比较,可作为判断金属性强弱依据的是________(选填编号)。
a.能否置换出铝盐溶液中铝
b.![]() 能否溶解在该元素最高价氧化物对应水化物中
能否溶解在该元素最高价氧化物对应水化物中
c.单质与氢气化合的难易程度
d.单质与同浓度的稀盐酸发生反应的剧烈程度
(6)在![]() 溶液中逐滴加入G的最高价氧化物的水化物,现象是先产生白色沉淀,然后白色沉淀逐渐消失。请用以上某化学方程式证明Al与G金属性的强弱。______________________。O的非金属性比N强,请用元素周期律的知识分析原因。___________________。
溶液中逐滴加入G的最高价氧化物的水化物,现象是先产生白色沉淀,然后白色沉淀逐渐消失。请用以上某化学方程式证明Al与G金属性的强弱。______________________。O的非金属性比N强,请用元素周期律的知识分析原因。___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用铁碳混合物处理含Cu2+废水获得金属铜。当保持铁屑和活性炭总质量不变时,测得废水中Cu2+浓度在不同铁碳质量比(x)条件下随时间变化的曲线如下图所示。
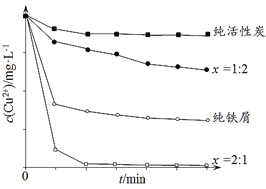
下列推论不合理的是
A. 活性炭对Cu2+具有一定的吸附作用
B. 铁屑和活性炭会在溶液中形成微电池,铁为负极
C. 增大铁碳混合物中铁碳比(x),一定会提高废水中Cu2+的去除速率
D. 利用铁碳混合物回收含Cu2+废水中铜的反应原理:Fe+Cu2+=Fe2++Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是
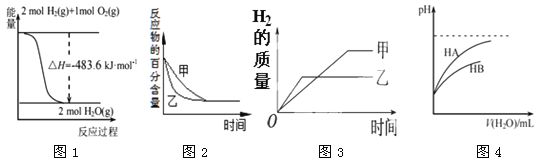
A.图1表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8 kJ·mol-1
B.图2表示压强对可逆反应2A(g)+2 B(g)![]() 3C(g)+D(s)的影响,乙的压强比甲的压强大
3C(g)+D(s)的影响,乙的压强比甲的压强大
C.图3表示等质量的钾、钠分别与足量水反应,则甲为钠
D.图4表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则相同条件下NaA溶液的pH大于同浓度的NaB溶液的pH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水AlCl3易升华,可用作有机合成的催化剂等。工业上以铝土矿(Al2O3、Fe2O3)为原料制备无水AlCl3的工艺流程如下:

(1) 氯化炉中Al2O3、Cl2和C反应的化学方程式为____________________。
(2)用Na2SO3溶液可除去冷却器排出的尾气中的Cl2,此反应的离子方程式为__________。
(3)升华器中主要含有AlCl3和FeCl3,需加入少量Al,其作用是________。
(4)为测定制得的无水AlCl3产品(含杂质FeCl3)的纯度,称取16.25 g无水AlCl3样品,溶于过量的NaOH溶液中,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,得其质量为0.32 g。
① 写出上述除杂过程中涉及的离子方程式___________、____________。
② AlCl3产品的纯度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向200 mL FeBr2溶液中逐渐通入Cl2,其中n(Fe 3+)、n(Br2) 随通入n(Cl2)的变化如图所示,下列说法不正确的是( )

A.氧化性强弱:Br2 > Fe3+
B.由图可知,该FeBr2溶液的浓度为1 mol·L-l
C.n(Cl2)=0. 12 mol时,溶液中的离子浓度有c (Fe 3+)∶c( Br-)=1∶8
D.n(FeBr2)∶n(Cl2)=1∶1时,反应的离子方程式为:2Fe2++2Br- + 2Cl2=2Fe3++Br2 + 4Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com