
【题目】钴的氧化物广泛应用于磁性材料及超导材料等领域。一种利用含钴废料(主要成分Co2O3,含少量Al2O3、MgO、SiO2等)制备Co2O3的工艺流程如下图所示。
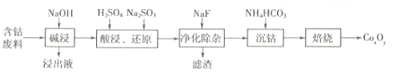
(1)“浸出液”的主要成分是________(写化学式)。
(2)“酸浸,还原”过程中溶解Co2O3的离子方程式为______________。稀硫酸和Na2SO3也可用盐酸替代,工业生产中不用盐酸的理由是_____________。
(3)NaF的作用是____________。
(4)“沉钴”时生成CoCO3的化学方程式为___________。检验CoCO3是否洗涤干净的操作方法是_______________。
(5)在空气中焙烧CoCO3生成CoxOy和CO2,测得充分煅烧后固体质量为4.82g,CO2的体积为1.344L(标准状况),则CoxOy的化学式为_____________。
【答案】NaAlO2、Na2SiO3Co2O3+SO32-+4H+=2Co2++SO42-+2H2O防止盐酸被Co203氧化为Cl2,污染环境除去镁离子CoSO4+2NH4HCO3=(NH4)2SO4+CoCO3↓+H2O+CO2↑取最后一次洗涤液少许于试管中,滴加盐酸Co3O4
【解析】
(1)Al2O3为两性氧化物,既可以与强酸反应也可以与强碱反应,SiO2可以与强碱反应,因此含钴废料经碱浸后,氧化铝与强碱反应生成偏铝酸钠,二氧化硅与氢氧化钠反应生成硅酸钠,因此“浸出液”的主要成分是NaAlO2、Na2SiO3;
(2)Co2O3与硫代硫酸根离子在酸性条件下发生氧化还原反应硫酸根离子、二价钴离子和水,离子方程式为:Co2O3+SO32-+4H+=2Co2++SO42-+2H2O;盐酸具有还原性还原产物有氯气,污染环境,因此工业上不用盐酸;
(3)氟离子与溶液中的镁离子结合成沉淀,经过滤除去镁离子;
(4)除杂后溶液中的主要成分是硫酸钴,硫酸钴与加入的碳酸氢氨反应生成硫酸铵、碳酸钴沉淀、二氧化碳和水,方程式为:CoSO4+2NH4HCO3=(NH4)2SO4+CoCO3↓+H2O+CO2↑;取最后一次洗涤液少许于试管中,滴加盐酸,如果没有气泡产生,则证明已经洗净;
(5)CO2的体积为1.344L(标准状况)的物质的量为1.344L÷22.4L/mol=0.06mol,由CoCO3的化学式可知n(Co)= n(C)=0.06mol,则m(Co)= n(Co)×M(Co)=0.06mol×59mol/g=3.54g,煅烧后固体中氧元素的物质的量为:n(O)= (4.82g-3.54g)÷16g/mol=0.08mol,则n(Co) :n(O)=0.06:0.08=3:4,因此灼烧后的化学式为Co3O4。


科目:高中化学 来源: 题型:
【题目】下列关于物质分类的说法正确的是( )
A.金刚石、白磷、水银都属于单质
B.重过磷酸钙、盐酸、水煤气都属于纯净物
C.氯化铵、碳酸、碳酸钙都属于强电解质
D.木炭、硫、磷在氧气中燃烧都发出白光
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,锥形瓶内盛有气体X,滴管内盛有液体Y。若挤 压胶头滴管的胶头,使液体滴入瓶中,振荡,套在玻璃管一端的小气球慢慢鼓起,则气体X和液体Y不可能是
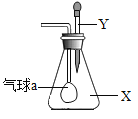
A. X是Cl2,Y是NaOH溶液
B. X是SO2,Y是澄清石灰水
C. X是NO,Y是水
D. X是NH3,Y是氯化钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M是一种合成药品的中间体,其合成路线如图所示。
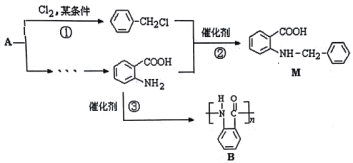
已知: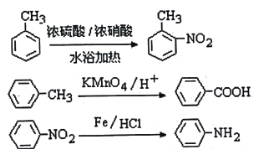
(弱碱性,易被氧化)
(1)写出反应①的化学方程式_____________。
(2)反应②属于____反应(填有机反应类型)。
(3)写出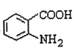 中官能团的名称__________。
中官能团的名称__________。
(4)H为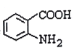 的同分异构体,则满足下列条件的H的同分异构体共有______种,其中满足下列条件且含4种不同氢原子的同分异构体的结构简式是___________。
的同分异构体,则满足下列条件的H的同分异构体共有______种,其中满足下列条件且含4种不同氢原子的同分异构体的结构简式是___________。
①显弱碱性,易被氧化 ②分子内含有苯环 ③能发生水解反应
(5)请你设计由A合成B的合成路线_________________________________________________________。
提示:①合成过程中无机试剂任选; ②合成路线表示方法示例如图所示。
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据表中信息,判断下列叙述中正确的是
序号 | 氧化剂 | 还原剂 | 其他反应物 | 氧化产物 | 还原产物 |
① | Cl2 | FeBr2 | / | Cl- | |
② | KClO3 | 浓盐酸 | / | Cl2 | |
③ | KMnO4 | H2O2 | H2SO4 | O2 | Mn2+ |
A.表中①组的反应可能有一种或两种元素被氧化
B.氧化性强弱的比较: KClO3>Fe3+>Cl2>Br2
C.表中②组反应的还原产物是KCl,电子转移数目是6e-
D.表中③组反应的离子方程式为:2MnO4-+ 3H2O2 + 6H+=2Mn2+ + 4O2↑+ 6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:

回答下列问题:
(1)NaClO2中Cl的化合价为_______。
(2)写出“反应”步骤中生成ClO2的化学方程式__________________________________。
(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去Mg2+和Ca2+,要加入的试剂分别为________、________。“电解”中阴极反应的主要产物是______。
(4)“尾气吸收”是吸收“电解”过程排出的少量ClO2。此吸收反应中,氧化剂与还原剂的物质的量之比为________,该反应中氧化产物是_________。
(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。NaClO2的有效氯含量为____。(计算结果保留两位小数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com