
【题目】NA为阿伏加德罗常数的值,下列叙述错误的是( )
A. 1.8gH2O中含有的质子数为NA
B. 22.4L氯气与足量镁粉充分反应,转移的电子数为2NA
C. 46gNO2和N2O4混合气体中含有原子总数为3NA
D. 23gNa与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 按系统命名法,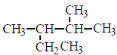 的名称为2-甲基-3-乙基丁烷
的名称为2-甲基-3-乙基丁烷
B. 聚乙烯(PE)和聚氯乙烯(PVC)的单体都是不饱和烃,均能使溴水褪色
C. 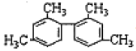 分子中至少有11个碳原子处于同一平面
分子中至少有11个碳原子处于同一平面
D. 有机物 与NaOH溶液反应,最多消耗4mol NaOH
与NaOH溶液反应,最多消耗4mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将SO2分别通入下列4种溶液中,有关说法正确的是
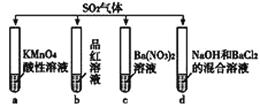
A. 试管a中实验可以证明SO2具有漂白性
B. 试管b中溶液褪色,说明SO2具有强氧化性
C. 试管c中能产生白色沉淀,该沉淀的成分为BaSO3
D. 试管d中能产生白色沉淀,该沉淀完全溶于稀盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在研究Fe与H2SO4的反应时,进行了如下实验。
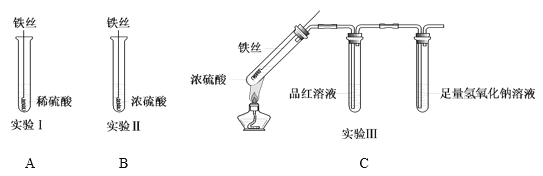
(1)实验Ⅰ中,铁与稀硫酸反应的离子方程式为______。
(2)实验Ⅱ中,铁丝表面迅速变黑,反应很快停止,其原因是______。
(3)实验Ⅲ中,加热后产生大量气体,A试管中溶液的红色褪去,C处始终未检测到可燃性气体。B试管中反应的离子方程式是______。
(4)对比实验Ⅰ、Ⅱ和Ⅲ,同学们得出以下结论:
①浓硫酸和稀硫酸都具有氧化性,但原因不同。浓硫酸的氧化性源于+6价的硫元素,稀硫酸的氧化性源于______。
②造成反应多样性的主要因素有______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知298K时,Ksp(NiS)=1.0×10-21,Ksp(NiCO3)=1.0×10-7 ;p(Ni)=-lg c(Ni2+),p(B)=-lg c(S2-)或-lg c(CO32-)。在含物质的量浓度相同的Na2S和Na2CO3的混合溶液中滴加Ni(NO3)2溶液产生两种沉淀,溶液中阳离子、阴离子浓度关系如图所示。下列说法错误的是

A. 常温下NiCO3的溶解度大于NiS的溶解度
B. 向d点对应的溶液中加入对应阴离子的钠盐,d点向b点移动
C. 对于曲线I,在b点加热,b点向c点移动
D. P为3.5且对应的阴离子是CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温条件下,可逆反应:2NO(g)+O2(g)![]() 2NO2(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是( )
2NO2(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是( )
①单位时间内生成n mol O2的同时生成2n mol NO2②单位时间内生成n mol O2的同时生成2n mol NO③用NO2、NO、O2表示的反应速率的比为2:2:1的状态④混合气体的颜色不再改变的状态⑤混合气体的密度不再改变的状态⑥混合气体的压强不再改变的状态⑦混合气体的平均相对分子质量不再改变的状态.
A. ①④⑥⑦ B. ②③⑤⑦ C. ①③④⑤ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮和磷元素的单质和化合物在农药生产及工业制造业等领域用途非常广泛,请根据提示回答下列问题:
(1)科学家合成了一种阳离子为“N5n+”,其结构是对称的,5个N排成“V”形,每个N原子都达到8电子稳定结构,且含有2个氮氮三键;此后又合成了一种含有“N5n+”化学式为“N8”的离子晶体,其电子式为___,其中的阴离子的空间构型为___。
(2)2001年德国专家从硫酸铵中检出一种组成为N4H4(SO4)2的物质,经测定,该物质易溶于水,在水中以SO42-和N4H44+两种离子的形式存在。N4H44+根系易吸收,但它遇到碱时会生成类似白磷的N4分子,不能被植物吸收。1个N4H44+中含有___个σ键。
(3)氨(NH3)和膦(PH3)是两种三角锥形气态氢化物,其键角分别为107°和93.6°,试分析PH3的键角小于NH3的原因___。
(4)P4S3可用于制造火柴,其分子结构如图1所示。
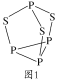
①P4S3分子中硫原子的杂化轨道类型为___。
②每个P4S3分子中含孤电子对的数目为___。
(5)某种磁性氮化铁的晶胞结构如图2所示,该化合物的化学式为___。若晶胞底边长为anm,高为cnm,则这种磁性氮化铁的晶体密度为__g·cm3(用含a、c和NA的式子表示)

(6)高温超导材料,是具有高临界转变温度(Te)能在液氮温度条件下工作的超导材料。高温超导材料镧钡铜氧化物中含有Cu3+。基态时Cu3+的电子排布式为[Ar]__;化合物中,稀土元素最常见的化合价是+3,但也有少数的稀土元素可以显示+4价,观察下面四种稀土元素的电离能数据,判断最有可能显示+4价的稀土元素是___(填元素符号)。
几种稀土元素的电离能(单位:kJ·mol1)
元素 | I1 | I2 | I3 | I4 |
Sc(钪) | 633 | 1235 | 2389 | 7019 |
Y(铱) | 616 | 1181 | 1980 | 5963 |
La(镧) | 538 | 1067 | 1850 | 4819 |
Ce(铈) | 527 | 1047 | 1949 | 3547 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。下列有关说法不正确的是
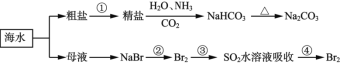
A.制取NaHCO3的反应是利用其溶解度小于NaCl
B.侯氏制碱应先通NH3再通CO2
C.在第②、③、④步骤中,溴元素均被氧化
D.③④的目的是进行溴的富集
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学反应中,设反应物的总能量为E1,生成物的总能量为E2,
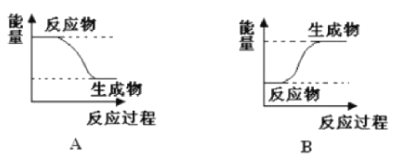
I.若E1>E2,则该反应为_____(填“放热”或“吸热”)反应。该反应可用图____(填“A”或“B”)表示。
II.若E1<E2,则该反应为______(填“放热”或“吸热”)反应。该反应可用图_____(填“A”或“B”)表示
III.下表中的数据是破坏1mol物质中的化学键所消耗的最小能量:
物质 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
键能(kJ/mol) | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
根据上述数据回答下列问题:
(1)下列物质本身具有的能量最低的是(_____)
A.H2 B.Cl2 C.Br2 D.I2
(2)下列氢化物中最稳定的是(_____)
A.HCl B.HBr C.HI
(3)X2+H2===2HX(X代表Cl、Br、I)的反应是吸热反应还是放热反应?_______。
(4)相同条件下,X2(X代表Cl、Br、I)分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的热量最多的是_____(填写化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com