
| A. | 48 mol•(L•s )-1 | B. | 36 mol•(L•s )-1 | C. | 24 mol•(L•s )-1 | D. | 12 mol•(L•s )-1 |
科目:高中化学 来源: 题型:实验题
 实验室用氯化钠固体配制1.00mol/L的NaCl溶液500mL,回答下列问题:
实验室用氯化钠固体配制1.00mol/L的NaCl溶液500mL,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 如果苯酚浓溶液沾到皮肤上,应立即用自来水冲洗 | |
| B. | 受溴腐蚀致伤时,应先用苯和甘油洗伤口,再用水洗 | |
| C. | 检验氨基酸时,可向氨基酸溶液中加双缩脲试剂,会呈现紫玫瑰色 | |
| D. | 纸层析法点样时应用玻璃棒蘸取试样,在滤纸条原点处轻轻点样,晾干后再点,重复3〜5次 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molC2H4Cl2中含有共用电子对数目为7NA | |
| B. | 标准状况下,44.8 L丙三醇与足量金属钠反应,生成气体的分子数为3NA | |
| C. | 20℃时,1 mol己烷完全燃烧后恢复至原状态,生成气态物质分子数为6NA | |
| D. | 15g甲基正离子(CH3+)所含有的电子数是8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
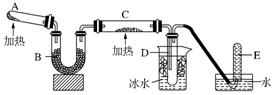
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.8g熟石膏(2CaSO4•H2O)含有的结晶水分子数为0.02NA | |
| B. | 在K37ClO3+6H35Cl(浓)═KCl+3Cl2↑+3H2O反应中,若有212克氯气生成,则反应中电子转移的数目为5NA | |
| C. | 60克的乙酸和葡萄糖混合物充分燃烧消耗2NA个O2 | |
| D. | 1mol CnH2n-2(n≥2)中所含的共用电子对数为(3n+1)NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com