
| A. | 因为溶有二氧化碳,所以酸雨的pH小于5.6 | |
| B. | 漂白粉是混合物,其成分为次氯酸钠和氯化钠 | |
| C. | 碳铵是常用的化学肥料,与草木灰混合使用效果更好 | |
| D. | 常用的灭火器成分有干冰、四氯化碳、小苏打和硫酸铝等 |
分析 A.溶有二氧化碳的雨水为正常雨水,pH为5.6;
B.漂白粉的主要成分为氯化钙和次氯酸钙;
C.铵态氮肥与碱性物质混合后能放出氨气,降低肥效;
D.二氧化碳、四氯化碳不易燃烧,可灭火.
解答 解:A.酸雨的pH小于5.6,原因是溶有二氧化硫或二氧化氮,而溶有二氧化碳的雨水属于正常雨水,故A错误;
B.氢氧化钙与氯气反应可制备漂白粉,则漂白粉的主要成分为次氯酸钙和氯化钙,故B错误;
C.铵态氮肥与碱性物质混合后能放出氨气,降低肥效;碳铵属于铵态氮肥,草木灰显碱性,碳铵与草木灰混合会放出氨气,降低肥效,故C错误;
D.二氧化碳、四氯化碳能灭火,常用的灭火器成分有干冰、四氯化碳、小苏打和硫酸铝等,故D正确;
故选D.
点评 本题考查较为综合,涉及酸雨成因、漂白粉组成、盐的水解原理、灭火器成分等知识,题目难度不大,明确灭火原理、漂白粉组成为解答关键,注意掌握盐的水解原理,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:解答题
| 物质 | SiO2 | MgCl2 | CaCl2 | SiCl4 |
| 熔点(℃) | 1723 | 712 | 782 | -68 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该检测仪利用了电解原理 | |
| B. | 质子交换膜具有类似盐桥的平衡电荷作用 | |
| C. | Pt(l)极反应为:CH3CH2OH-4e-+H2O=4H++CH3COOH | |
| D. | 工作中电子由Pt(l)电极经过质子交换膜流向Pt(II) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应物的总能量大于生成物的总能量时,△H>0 | |
| B. | △H>0表示放热反应,△H<0表示吸热反应 | |
| C. | △H的大小与热化学方程式中的各物质的化学计量数无关 | |
| D. | 在化学反应中,发生物质变化的同时一定发生能量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在CH2=CH2分子中,存在4个σ键和一个π键 | |
| B. | 在共价化合物中,一定存在极性键,可能存在非极性键,一定不存在离子键 | |
| C. | N、O、F电负性大小:F>O>N;第一电离能大小:F>O>N | |
| D. | 酸性强弱:H2SO4>H2SO3>H2SeO3;岩浆晶出的先后顺序:SiO2、MgSiO3、CaSiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
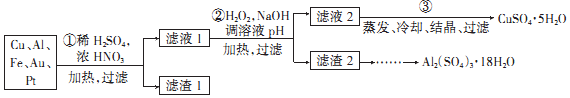
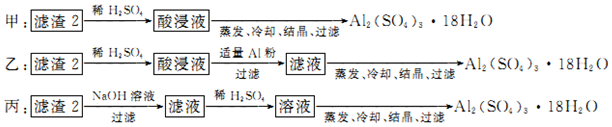
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA | |
| B. | 0.1 mol丙烯酸(CH2=CHCOOH)中含有碳原子的数目为0.2NA | |
| C. | 标准状况下,11.2LCCl4中含有分子的数目为0.5NA | |
| D. | 在2Na2O2+2H2O═4NaOH+O2↑的反应中,每生成0.1 mol氧气,转移电子的数目为0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com