
分析 与相同氧化剂反应时,还原性越强的离子越先参加氧化还原反应,根据其还原能力大小顺序知,离子被氧化顺序是Fe2+>Br-,FeBr2的溶液中,通入氯气,氯气先是将亚铁离子氧化,亚铁离子氧化完毕以后,再氧化溴离子,根据反应的先后顺序结合物质的量进行回答.
解答 解:(1)当x≤$\frac{n}{2}$时,氯气的量较少,氯气只是将亚铁离子氧化,发生反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-; 故答案为:2Fe2++Cl2=2Fe3++2Cl-;
(2)当反应的离子方程式为:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl-时,氯气已经将溴化亚铁中的亚铁离子和溴离子全部氧化完毕,氯气得到电子总数等于亚铁离子和溴离子失电子的总数,此时x与n的关系是2x=3n,故答案为:2x=3n;
(3)当x≤$\frac{n}{2}$时,氯气的量较少,氯气只是将亚铁离子氧化,当Fe2+和Br-同时被氧化时,x与n的关系是x>$\frac{n}{2}$,故答案为:x>$\frac{n}{2}$;
(4)当x=n时,根据反应:2Fe2++Cl2=2Fe3++2Cl-; nmol亚铁离子被氧化,消耗氯气是0.5nmol,氧化产物Fe3+的物质的量为nmol,然后是0.5nmol的氯气将溴离子氧化,根据2Br-+Cl2═Br2+2Cl-,0.5nmol的氯气能将nmol的溴离子氧化,所以溴离子会剩余,得到氧化产物Br2的物质的量为0.5nmol,所以反应后氧化产物的物质的量为1.5nmol.
故答案为:1.5n.
点评 本题考查了以氧化还原反应为载体考查了离子还原性强弱,明确离子反应先后顺序是解本题关键,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 原子结构模型演变过程中卢瑟福提出了带核的原子结构模型 | |
| B. | 瑞典化学家舍勒发现了氯气,英国化学家戴维确认了氯气的性质 | |
| C. | 英国化学家戴维首次在实验室制得了金属钠 | |
| D. | 我国化工专家侯德榜发明了向氯化钠饱和溶液中通入CO2制取纯碱的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等体积、等浓度的KHSO4溶液与Ba(OH)2溶液反应:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| B. | 在次氯酸中加入碳酸钠:2HClO+CO32-═2ClO-+H2O+CO2↑ | |
| C. | 钾与水反应:2K+2H2O═2K++2OH-+H2↑ | |
| D. | 氯化钠溶液中通入氟气:F2+2Cl-═2F-+Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
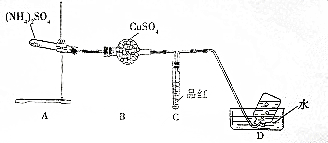
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向4mL0.01mol/LKMnO4酸性溶液中加入2mL0.1mol/LH2C2O4溶液:溶液褪色 | |
| B. | 浓度均为0.1mol/L的Na2S2O3和H2SO4溶液等体积混合:溶液变浑浊 | |
| C. | 将盛有NO2和N2O4混合气体的容器压缩:混合气体颜色比压缩前浅 |
查看答案和解析>>
科目:高中化学 来源:2017届重庆市高三上适应性考试二化学试卷(解析版) 题型:选择题
固体粉未X可能含有Fe、Fe3O4、CuO、MnO2、Na2SO4和NaSO3中的若干种,为确定该固体粉末的成分,某同学依次进行了以下实验:①将X加人足量水中,得到不溶物Y和溶液Z;②取少量Y加人足最浓盐酸,加热,产生黄绿色气体.并有少量红色不溶物;③向Z溶液中滴加BaCl2溶液,生成白色沉淀,再加足量稀硝酸沉淀不溶解。分析以上实验现象,下列结论正确的是
A.X中一定不存在Fe3O4
R.Y中不一定存在MnO2
C.Z溶液中一定含有Na2SO4
D.不溶物Y中一定含有Fe和CuO
查看答案和解析>>
科目:高中化学 来源:2017届山西大学附中高三上10月模块诊断化学试卷(解析版) 题型:选择题
1.92g铜投入一定量的浓硝酸中,铜完全溶解,生成气体颜色越来越浅,共收集到672 mL气体(标准状况),将盛有此气体的容器倒扣在水中,通入氧气恰好使气体完全溶解在水中,则需要标准状况下的氧气体积为( )
A.504 mL B.168 mL C.224mL D.336 mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com