
【题目】科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图所示),与白磷分子相似。气态时,已知断裂1mol N—N键吸收167kJ热量,断裂1mol N≡N键吸收942kJ热量,则( )
A.N4与N2互称为同位素
B.N4属于一种新型的化合物
C.N4化学性质比N2稳定
D.1mol N4气体转化为N2时要放出882kJ能量
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.冰和水晶都是分子晶体
B.原子晶体一定是共价化合物
C.某物质固态时不导电但在熔融状态下能导电,则该物质中一定含有离子键
D.干冰是分子晶体,其溶于水生成碳酸的过程只需克服分子间作用力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除杂试剂或操作方法正确的一组是( )
序号 | 物质 | 杂质 | 除杂试剂或操作方法 |
① | NaCl | BaCl2 | 加入过量的K2CO3溶液,过滤,再加适量的盐酸并加热 |
② | FeSO4溶液 | CuSO4 | 加入过量Fe粉,过滤 |
③ | H2 | HCl | 通过盛NaHCO3溶液洗气瓶,再通过盛H2SO4洗气瓶 |
④ | 自来水 | 植物油 | 蒸馏 |
A.①③④B.②③④C.②④D.②
查看答案和解析>>
科目:高中化学 来源: 题型:
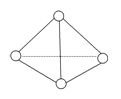
【题目】在25℃时,碳酸钙在水中的沉淀溶解平衡曲线如图所示,已知25℃时硫酸钙的Ksp=9.1×10-6。下列说法不正确的是
A. 除去锅炉水垢中硫酸钙的办法是将其转化为碳酸钙,然后用酸去除
B. 图中b点碳酸钙的结晶速率大于其溶解速率
C. 通过蒸发,可使溶液由a点变化到c点
D. 在25℃时,反应CaSO4(s)+CO32-(aq)===CaCO3(s)+SO42-(aq)的平衡常数K=3250
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下,其中正确的是( )
①Zn为正极,Cu为负极;
②H+向负极移动;
③电子是由Zn经外电路流向Cu;
④Cu极上有H2产生;
⑤若有1mol电子流过导线,则产生的H2为0.5mol;
⑥正极的电极反应式为Zn﹣2e﹣═Zn2+.

A.①②③ B.③④⑤ C.④⑤⑥ D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
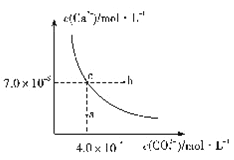
【题目】二甲醚是一种清洁能源,用水煤气制取甲醚的原理如下:
I.CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
II.2CH3OH(g)===CH3OCH3(g)+H2O(g)
(1)300℃和500℃时,反应I的平衡常数分别为K1、K2,且K1>K2,则其正反应为_______反应(填“吸热”或“放热”)。
(2)在恒容密闭容器中发生反应I:
①下图能正确反映体系中甲醇体积分数随温度变化情况的曲线是______________(填“a”或“b”)。
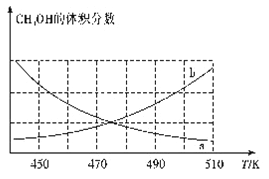
②下列说法能表明反应已达平衡状态的是____(填标号)。
A.容器中气体的压强不再变化 B.混合气体的密度不再变化
C.混合气体的平均相对分子质量不再变化 D.v正(H2)=2v正(CH3OH)
(3)500K时,在2L密闭容器中充入4 mol CO和8 mol H2,4 min达到平衡,平衡时CO的转化率为80%,且2c(CH3OH)=c(CH3OCH3) ,则:
① 0~4 min,反应I的v(H2)=______,反应I的平衡常数K=______。
② 反应II中CH3OH的转化率α=_______。

(4)二甲醚燃料电池的工作原理如图听示,则X电极的电极反应式为_______。用该电池对铁制品镀铜,当铁制品质量增加64 g时,理论上消耗二甲醚的质量为_______g(精确到0.01)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中通常伴随着能量变化,下列说法中错误的是( )
A. 煤燃烧时并不能将化学能全部转化为热能
B. 原电池将化学能转化为电能
C. 二次电池放电时将电能转化为化学能
D. 镁条燃烧时将部分化学能转化为光能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关仪器用途的说法正确的是
A. 试管、烧杯均可用于给液体、固体加热
B. 使食盐水中NaCl结晶析出时,用到的仪器有坩埚、酒精灯、玻璃棒、泥三角
C. 区别NaCl、Na2SO4时常用到胶头滴管、试管
D. 漏斗可用于过滤及向滴定管中添加溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以白云石(化学式表示为MgCO3·CaCO3)为原料制备氢氧化镁的工艺流程如下:
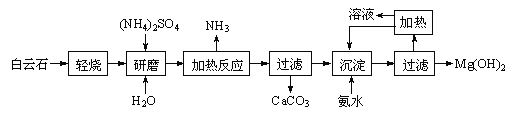
已知:①白云石加热过程中,固体失重百分比与温度的关系如下图所示:
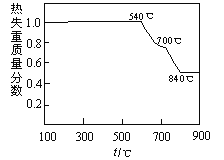
② Ksp[Mg(OH)2]=5.61×10-12。
(1)根据流程图判断白云石“轻烧”后固体产物的主要成份 _____(填化学式)。结合上图判断“轻烧”温度应不超过 _____。
(2)“加热反应”的化学方程式为_________________________。
(3)沉淀过程溶液的pH=9.5,此时溶液中c(Mg2+)= _______(已知)。
(4)该工艺中可以循环使用的物质是________(填化学式)。
(5)传统工艺将白云石分解为氧化镁和氧化钙后提取,从环境保护的用度分析,该工艺采用轻烧白云石的方法,其优点是__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com