
”°µĶĢ¼Ń»·”±ŅżĘšø÷¹śµÄø߶ČÖŲŹÓ£¬¶ųČēŗĪ½µµĶ“óĘųÖŠCO2µÄŗ¬Įæ¼°ÓŠŠ§µŲæŖ·¢ĄūÓĆCO2£¬ŅżĘšĮĖČ«ŹĄ½ēµÄĘÕ±éÖŲŹÓ”£ĖłŅŌ”°µĶĢ¼¾¼Ć”±Õż³ÉĪŖæĘѧ¼ŅŃŠ¾æµÄÖ÷ŅŖæĪĢā”£
£Ø1£©ÓƵē»”·ØŗĻ³ÉµÄ“¢ĒāÄÉĆ×Ģ¼¹Ü³£°éÓŠ“óĮæµÄĢ¼ÄÉĆ×æÅĮ££ØŌÓÖŹ£©£¬ÕāÖÖæÅĮ£æÉÓĆČēĻĀŃõ»Æ·ØĢį“棬ĒėĶź³ÉøĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½£¬²¢ŌŚ·½æņÄŚĢīÉĻĻµŹż”£
ӛC+ӛKMnO4+ӛH2SO4 =ӛCO2ӟ+ӛMnSO4 +ӛK2SO4+ӛ
£Ø2£©½«²»Ķ¬ĮæµÄCO£Øg£©ŗĶH2O£Øg£©·Ö±šĶØČėµ½Ģå»żĪŖ2LµÄŗćČŻĆܱÕČŻĘ÷ÖŠ£¬½ųŠŠ·“Ó¦CO£Øg£©£«H2O£Øg£© CO2£Øg£©£«H2£Øg£©£¬µĆµ½ČēĻĀ¶ž×鏿¾Ż£ŗ
CO2£Øg£©£«H2£Øg£©£¬µĆµ½ČēĻĀ¶ž×鏿¾Ż£ŗ
| ŹµŃé×é | ĪĀ¶Č”ę | ĘšŹ¼Įæ/mol | Ę½ŗāĮæ/mol | “ļµ½Ę½ŗāĖłŠčŹ±¼ä/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1£®6 | 2£®4 | 6 |
| 2 | 900 | 2 | 1 | 0£®4 | 1£®6 | 3 |
£Ø16·Ö£©
£Ø1£©5 C+4KMnO4 +6 H2SO4=5CO2”ü+4MnSO4+2K2SO4+6H2O£Ø3·Ö£¬ĪļÖŹ1·Ö£¬ÅäĘ½2·Ö£©
£Ø2£©¢Ł0.13mol/(L”¤min) (2·Ö) ¢Ś0.17£Ø2·Ö£©£» ·ÅČČ£Ø2·Ö£©
£Ø3£©2CH3OH(l)+2O2(g)=2CO(g)+4H2O(g) ¦¤H=”Ŗ709.6kJ/mol»ņCH3OH£Øl£©+O2£Øg£©= CO£Øg£©+2H2O£Øg£©¦¤H=”Ŗ354.8kJ/mol£Ø3·Ö£©
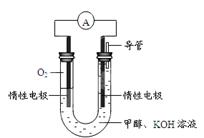
£Ø4£©¢ŁO2 + 4e£+ 2 H2O = 4OH££Ø2·Ö£©””””””¢Śøŗ£Ø2·Ö£©
½āĪöŹŌĢā·ÖĪö£ŗ£Ø1£©¹Ū²ģ»Æѧ·½³ĢŹ½£¬ĻČÕŅ±ä¼ŪŌŖĖŲ£¬ŌŁøł¾Ż»ÆŗĻ¼Ū±ä»Æ£¬ÓĆ×īŠ”¹«±¶Źż·ØĻČÅäŃõ»Æ¼ĮŗĶ»¹Ō¼ĮµÄĻµŹż£¬×īŗóÓĆ¹Ū²ģ·ØÅäĘ½ø÷ĪļÖŹµÄĻµŹż£»Ģ¼ŌŖĖŲÓÉ0¼ŪÉżĪŖ+4¼Ū£¬ĆĢŌŖĖŲÓÉ+7¼Ū½µĪŖ+2¼Ū£¬¶žÕßÉż½µŹż·Ö±šĪŖ4”¢5£¬Ōņ×īŠ”¹«±¶ŹżĪŖ20£¬ĖłŅŌøĆ·“Ó¦ĪŖ5C+4KMnO4 +6H2SO4=5CO2”ü+4MnSO4+2K2SO4+6H2O£»£Ø2£©¢Ł¶Į±ķÖŠŠÅĻ¢£¬ĻČÓɶØŅåŹ½Ēóv(CO)£¬ŌŁÓÉĻµŹż±ČĒóv(CO2)£¬¼“v(CO)=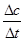 =
=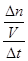 =
=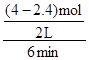 = 0.13mol/(L”¤min)£Ø±£ĮōĮ½Ī»ÓŠŠ§Źż×Ö£©£¬ÓÉÓŚ
= 0.13mol/(L”¤min)£Ø±£ĮōĮ½Ī»ÓŠŠ§Źż×Ö£©£¬ÓÉÓŚ =
= £¬Ōņv(CO2)=v(CO)=0.13mol/(L”¤min)£»¢Ś±ķÖŠŹµŃé2ÓŠ¹Ų×é·ÖµÄĘšŹ¼ĪļÖŹµÄĮæ”¢Ę½ŗāĪļÖŹµÄĮæŅŃÖŖ£¬ČŻĘ÷Ģå»żĪŖ2L£¬ÓÉÓŚc=n/V£¬Ōņ£ŗ
£¬Ōņv(CO2)=v(CO)=0.13mol/(L”¤min)£»¢Ś±ķÖŠŹµŃé2ÓŠ¹Ų×é·ÖµÄĘšŹ¼ĪļÖŹµÄĮæ”¢Ę½ŗāĪļÖŹµÄĮæŅŃÖŖ£¬ČŻĘ÷Ģå»żĪŖ2L£¬ÓÉÓŚc=n/V£¬Ōņ£ŗ
CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
ĘšŹ¼ÅØ¶Č£Ømol/L£© 1 0.5 0 0
±ä»ÆÅØ¶Č£Ømol/L£© 0.2 0.2 0.2 0.2
Ę½ŗāÅØ¶Č£Ømol/L£© 0.8 0.3 0.2 0.2
K=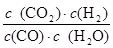 =
=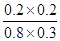 =0.17
=0.17
ČōÓƱķÖŠŹµŃé1ÓŠ¹Ų×é·ÖµÄĘšŹ¼ĪļÖŹµÄĮæ”¢Ę½ŗāĪļÖŹµÄĮæŅŃÖŖ£¬ČŻĘ÷Ģå»żĪŖ2L£¬ÓÉÓŚc=n/V£¬Ōņ£ŗ
CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
ĘšŹ¼ÅØ¶Č£Ømol/L£© 2 1 0 0
±ä»ÆÅØ¶Č£Ømol/L£© 0.8 0.8 0.8 0.8
Ę½ŗāÅØ¶Č£Ømol/L£© 1.2 0.2 0.8 0.8
K`=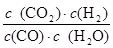 =
=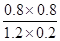 =2.67
=2.67
650”ꔜ900”ę£¬ÉżøßĪĀ¶Č£¬Ę½ŗāĻņĪüČČ·“Ó¦·½ĻņŅĘ¶Æ£»Ę½ŗā³£ŹżÓÉ2.67¼õÉŁĪŖ0.17£¬ĖµĆ÷Ę½ŗāĻņÄę·“Ó¦·½ĻņŅĘ¶Æ£¬ŌņÄę·“Ó¦ŹĒĪüČČ·“Ó¦£¬ĖłŅŌÕż·“Ó¦ŹĒ·ÅČČ·“Ó¦£»
£Ø3£©¹Ū²ģ3øöČČ»Æѧ·½³ĢŹ½£¬·¢ĻÖ¢Ł”Ŗ¢ŚæÉŅŌŌ¼Č„2CO2(g)£¬øł¾ŻøĒĖ¹¶ØĀÉ£¬Ōņ2CH3OH(l)+2O2(g)=2CO(g)+4H2O(g) ¦¤H=”Ŗ709.6kJ/mol£¬ČōĻµŹż¼õ°ė£¬ŌņCH3OH(l)+O2(g)=CO(g)+2H2O(g) ¦¤H=”Ŗ354.8kJ/mol£»£Ø4£©¢Ł¼×ĶéČ¼ĮĻµē³ŲµÄÕż¼«·“Ó¦ĪļŹĒŃõĘų£¬ÓÉÓŚKOHČÜŅŗĻŌ¼īŠŌ£¬øł¾Żµē×Ó”¢µēŗÉ”¢Ō×ÓŹŲŗćŌĄķ£¬ŌņÕż¼«·“Ó¦Ź½ĪŖO2+4e£+ H2O=4OH££»¢Śµē×Ó“ųøŗµē£¬µē¼«²ÄĮĻ±¾Éķ²»“ųµē£¬øŗ¼«Į÷³öµē×Ó“ųÕżµē£¬Ņņ“ĖČÜŅŗÖŠ“ųøŗµēµÄĒāŃõøłĄė×ÓŅĘĻņøŗ¼«£»¶ųÕż¼«Į÷Čėµē×Ó“ųøŗµē£¬Ņņ“ĖČÜŅŗÖŠ“ųÕżµēµÄŃōĄė×ÓŅĘĻņÕż¼«”£
æ¼µć£ŗæ¼²é»Æѧ·“Ó¦ŌĄķ£¬Éę¼°Ńõ»Æ»¹Ō·“Ó¦·“Ó¦·½³ĢŹ½µÄÅäĘ½”¢Ę½¾ł·“Ó¦ĖŁĀŹµÄ¼ĘĖć”¢»ÆŃ§Ę½ŗā³£ŹżµÄ¼ĘĖćÓė±Č½Ļ”¢ĪĀ¶Č¶ŌĘ½ŗāŅĘ¶ÆµÄÓ°Ļģ¹ęĀɵÄÓ¦ÓĆ”¢·ÅČČ·“Ó¦ŗĶĪüČČ·“Ó¦”¢øĒĖ¹¶ØĀÉ”¢Č¼ĮĻµē³ŲµÄÕż¼«·“Ó¦Ź½”¢Ąė×Ó¶ØĻņŅĘ¶Æ¹ęĀɵÄÓ¦ÓƵȔ£


 ĢģĢģĻņÉĻŅ»±¾ŗĆ¾ķĻµĮŠ“š°ø
ĢģĢģĻņÉĻŅ»±¾ŗĆ¾ķĻµĮŠ“š°ø Š”ѧɜ10·ÖÖÓÓ¦ÓĆĢāĻµĮŠ“š°ø
Š”ѧɜ10·ÖÖÓÓ¦ÓĆĢāĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĪŹ“šĢā
[15·Ö]¼×Ķé×ŌČČÖŲÕūŹĒĻČ½ųµÄÖĘĒā·½·Ø£¬°üŗ¬¼×ĶéŃõ»ÆŗĶÕōĘūÖŲÕū”£Ļņ·“Ó¦ĻµĶ³Ķ¬Ź±ĶØČė¼×Ķ锢ŃõĘųŗĶĖ®ÕōĘų£¬·¢ÉśµÄÖ÷ŅŖ»Æѧ·“Ó¦ÓŠ£ŗ
| ·“Ó¦¹ż³Ģ | »Æѧ·½³ĢŹ½ | ģŹ±ä”÷H (kJ/mol) | »ī»ÆÄÜEa (kJ/mol) |
| ¼×ĶéŃõ»Æ | CH4(g)£«2O2(g) CO2(g)£«2H2O(g) CO2(g)£«2H2O(g) | £802.6 | 125.6 |
CH4(g)£«O2(g) CO2(g)£«2H2(g) CO2(g)£«2H2(g) | £322.0 | 172.5 | |
| ÕōĘūÖŲÕū | CH4(g)£«H2O(g) CO(g)£«3H2(g) CO(g)£«3H2(g) | 206.2 | 240.1 |
CH4(g)£«2H2O(g) CO2(g)£«4H2(g) CO2(g)£«4H2(g) | 165.0 | 243.9 |
 CO2(g)£«H2(g)µÄ”÷H= kJ/mol”£
CO2(g)£«H2(g)µÄ”÷H= kJ/mol”£ CO(g)£«3H2(g)µÄKP£½ £»
CO(g)£«3H2(g)µÄKP£½ £»
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¼ĘĖćĢā
ŌŚ2LČŻĘ÷ÖŠ3ÖÖĪļÖŹ¼ä½ųŠŠ·“Ó¦£¬X”¢Y”¢ZµÄĪļÖŹµÄĮæĖꏱ¼äµÄ±ä»ÆĒśĻßČēĶ¼”£·“Ó¦ŌŚtŹ±µ½“ļĘ½ŗā£¬ŅĄĶ¼ĖłŹ¾£ŗ
¢ŁøĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½ŹĒ”” ”£
¢Ś·“ӦʚŹ¼ÖĮt£¬YµÄĘ½¾ł·“Ó¦ĖŁĀŹŹĒ ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¼ĘĖćĢā
£Ø1£©½«²»Ķ¬ĮæµÄCO£Øg£©ŗĶH2O£Øg£©·Ö±šĶØČėĢå»ż2LµÄŗćČŻĆܱÕČŻĘ÷ÖŠ£¬½ųŠŠ·“Ó¦CO£Øg£©+H2O£Øg£© CO2£Øg£©+H2£Øg£©£¬µĆµ½ČēĻĀĮ½×鏿¾Ż£ŗ
CO2£Øg£©+H2£Øg£©£¬µĆµ½ČēĻĀĮ½×鏿¾Ż£ŗ
| ŹµŃé×é | ĪĀ¶Č/”ę | ĘšŹ¼Įæ/mol | Ę½ŗāĮæ/mol | “ļµ½Ę½ŗāĖłŠčŹ±¼ä/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¼ĘĖćĢā
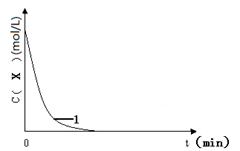
ŅŃÖŖ£ŗ½«KI”¢ŃĪĖį”¢ŹŌ¼ĮXŗĶµķ·ŪĖÄÖÖČÜŅŗ»ģŗĻ£¬ĪŽ·“Ó¦·¢Éś”£ČōŌŁ¼ÓČėĖ«ŃõĖ®£¬½«·¢Éś·“Ó¦£ŗH2O2+2H++2I”Ŗ”ś2H2O+I2£¬ĒŅÉś³ÉµÄI2Į¢¼“ÓėŹŌ¼ĮX·“Ó¦¶ų±»ĻūŗÄ”£Ņ»¶ĪŹ±¼äŗó£¬ŹŌ¼ĮX½«±»·“Ӧɜ³ÉµÄI2ĶźČ«ĻūŗÄ”£ÓÉÓŚČÜŅŗÖŠµÄI”Ŗ¼ĢŠų±»H2O2Ńõ»Æ£¬Éś³ÉµÄI2Óėµķ·Ū×÷ÓĆ£¬ČÜŅŗĮ¢¼“±äĄ¶”£Ņņ“Ė£¬øł¾ŻŹŌ¼ĮXµÄĮ攢µĪČėĖ«ŃõĖ®ÖĮČÜŅŗ±äĄ¶ĖłŠčµÄŹ±¼ä£¬¼“æÉĶĘĖć·“Ó¦H2O2+2H++2I”Ŗ”ś2H2O+I2µÄ·“Ó¦ĖŁĀŹ”£
ĻĀ±ķĪŖijĶ¬Ń§ŅĄ¾ŻÉĻŹöŌĄķÉč¼ĘµÄŹµŃé¼°ŹµŃé¼ĒĀ¼£Øø÷ŹµŃé¾łŌŚŹŅĪĀĢõ¼žĻĀ½ųŠŠ£©£ŗ
| ±ąŗÅ | ĶłÉÕ±ÖŠ¼ÓČėµÄŹŌ¼Į¼°ĘäÓĆĮæ£ØmL£© | “߻ƼĮ | æŖŹ¼±äĄ¶Ź±¼ä£Ømin£© | ||||
| 0.1 mol”¤L”„1 KIČÜŅŗ | H2O | 0.01 mol”¤L”„1 XČÜŅŗ | 0.1 mol”¤L”„1 Ė«ŃõĖ® | 1 mol”¤L”„1 Ļ”ŃĪĖį | |||
| 1 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | ĪŽ | 1.4 |
| 2 | 20.0 | m | 10.0 | 10.0 | n | ĪŽ | 2.8 |
| 3 | 10.0 | 20.0 | 10.0 | 20.0 | 20.0 | ĪŽ | 2.8 |
| 4 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 5µĪFe2(SO4)3 | 0.6 |
 2AlI3£Øs£©”£ŗ¬I”Ŗ“«µ¼ÓŠ»ś¾§ĢåŗĻ³ÉĪļ×÷ĪŖµē½āÖŹ£¬øƵē³Ųøŗ¼«µÄµē¼«·“Ó¦ĪŖ£ŗ______________________________£¬³äµēŹ±AlĮ¬½ÓµēŌ“µÄ___________¼«”£
2AlI3£Øs£©”£ŗ¬I”Ŗ“«µ¼ÓŠ»ś¾§ĢåŗĻ³ÉĪļ×÷ĪŖµē½āÖŹ£¬øƵē³Ųøŗ¼«µÄµē¼«·“Ó¦ĪŖ£ŗ______________________________£¬³äµēŹ±AlĮ¬½ÓµēŌ“µÄ___________¼«”£²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¼ĘĖćĢā
£Ø1£©N2(g)+3H2(g) 2NH3(g) ”÷H=£94.4kJ”¤mol£1”£ŗćČŻŹ±£¬ĢåĻµÖŠø÷ĪļÖŹÅضČĖꏱ¼ä±ä»ÆµÄĒśĻßČēĶ¼Ź¾”£
2NH3(g) ”÷H=£94.4kJ”¤mol£1”£ŗćČŻŹ±£¬ĢåĻµÖŠø÷ĪļÖŹÅضČĖꏱ¼ä±ä»ÆµÄĒśĻßČēĶ¼Ź¾”£
¢ŁŌŚ1LČŻĘ÷ÖŠ·¢Éś·“Ó¦£¬Ē°20minÄŚ£¬v(NH3)= £¬·Å³öµÄČČĮæĪŖ £»
¢Ś25minŹ±²ÉČ”µÄ“ėŹ©ŹĒ £»
¢ŪŹ±¶ĪIIIĢõ¼žĻĀ£¬·“Ó¦µÄĘ½ŗā³£Źż±ķ“ļŹ½ĪŖ £ØÓĆ¾ßĢåŹż¾Ż±ķŹ¾£©”£
£Ø2£©µē³§ŃĢĘųĶѵŖµÄÖ÷·“Ó¦¢Ł£ŗ4NH3(g)+6NO(g) 5N2(g)+6H2O(g) ”÷H<0£¬ø±·“Ó¦¢Ś£ŗ2NH3(g)+8NO(g)
5N2(g)+6H2O(g) ”÷H<0£¬ø±·“Ó¦¢Ś£ŗ2NH3(g)+8NO(g) 5N2O(g)+3H2O(g) ”÷H£¾0”£Ę½ŗā»ģŗĻĘųÖŠN2ÓėN2Oŗ¬ĮæÓėĪĀ¶ČµÄ¹ŲĻµČēÓŅĶ¼”£Ēė»Ų“š£ŗŌŚ400K”«600KŹ±£¬Ę½ŗā»ģŗĻĘųÖŠN2ŗ¬ĮæĖęĪĀ¶ČµÄ±ä»Æ¹ęĀÉŹĒ £¬µ¼ÖĀÕāÖÖ¹ęĀɵÄŌŅņŹĒ £ØČĪ“šŗĻĄķµÄŅ»ĢõŌŅņ£©”£
5N2O(g)+3H2O(g) ”÷H£¾0”£Ę½ŗā»ģŗĻĘųÖŠN2ÓėN2Oŗ¬ĮæÓėĪĀ¶ČµÄ¹ŲĻµČēÓŅĶ¼”£Ēė»Ų“š£ŗŌŚ400K”«600KŹ±£¬Ę½ŗā»ģŗĻĘųÖŠN2ŗ¬ĮæĖęĪĀ¶ČµÄ±ä»Æ¹ęĀÉŹĒ £¬µ¼ÖĀÕāÖÖ¹ęĀɵÄŌŅņŹĒ £ØČĪ“šŗĻĄķµÄŅ»ĢõŌŅņ£©”£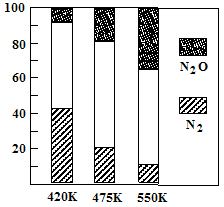
£Ø3£©Ö±½Ó¹©°±Ź½Č¼ĮĻµē³ŲŹĒŅŌNaOHČÜŅŗĪŖµē½āÖŹµÄ”£µē³Ų·“Ó¦ĪŖ£ŗ4NH3+3O2=2N2+6H2O£¬Ōņøŗ¼«µē¼«·“Ó¦Ź½ĪŖ ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
æŲÖʱäĮæ·ØŹĒŃŠ¾æ»Æѧ±ä»Æ¹ęĀɵÄÖŲŅŖĖ¼Ļė·½·Ø”£Ēė׊Ļø¹Ū²ģĻĀ±ķÖŠ50mlĻ”ŃĪĖįŗĶ1gĢ¼ĖįøĘ·“Ó¦µÄŹµŃ鏿¾Ż£ŗ
| ŹµŃé ŠņŗÅ | Ģ¼ĖįøĘדĢ¬ | c(HCl)/mol”¤L-1 | ČÜŅŗĪĀ¶Č/oC | Ģ¼ĖįøĘĻūŹ§Ź±¼ä/s | |
| ·“Ó¦Ē° | ·“Ó¦ŗó | ||||
| 1 | Į£×“ | 0£®5 | 20 | 39 | 400 |
| 2 | ·ŪÄ© | 0£®5 | 20 | 40 | 60 |
| 3 | Į£×“ | 0£®6 | 20 | 41 | 280 |
| 4 | Į£×“ | 0£®8 | 20 | 40 | 200 |
| 5 | ·ŪÄ© | 0£®8 | 20 | 40 | 30 |
| 6 | Į£×“ | 1£®0 | 20 | 40 | 120 |
| 7 | Į£×“ | 1£®0 | 30 | 50 | 40 |
| 8 | Į£×“ | 1£®2 | 20 | 40 | 90 |
| 9 | Į£×“ | 1£®2 | 25 | 45 | 40 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
²ŻĖį£ØH2C2O4£©ČÜŅŗÓėĖįŠŌKMnO4ČÜŅŗ·“Ó¦Ź±£¬ČÜŅŗĶŹÉ«×ÜŹĒĻČĀżŗóæģ”£Ä³Ń§Ļ°Š”×é½įŗĻ»Æѧ·“Ó¦ŌĄķĢį³ö²ĀĻėÓė¼ŁÉč£¬²¢Éč¼ĘĮĖŅ»ĻµĮŠŹµŃé½ųŠŠĢ½¾æ”£
ŹµŃé¢ń£ŗŌŚ2Ö§ŹŌ¹ÜÖŠ·Ö±š¼ÓČė5 mLµČÅØ¶ČµÄH2C2O4ČÜŅŗ£¬ŌŚĘäÖŠŅ»Ö§ŹŌ¹ÜÖŠĻČ¼ÓČėÉŁĮæMnSO4¹ĢĢåŌŁø÷¼ÓČė5µĪ0.1 mol”¤L-1 KMnO4ČÜŅŗ”£¼ĒĀ¼ČÜŅŗĶŹÉ«Ź±¼ä£¬Čē±ķ1£ŗ
| ŹŌ ¹Ü | Ī“¼ÓMnSO4µÄŹŌ¹Ü | ¼ÓÓŠMnSO4µÄŹŌ¹Ü |
| ĶŹÉ«Ź±¼ä | 30 s | 2 s |
| ŹŌ ¹Ü | Ī“µĪ¼ÓĻ”ĮņĖįµÄŹŌ¹Ü | µĪ¼ÓĮĖĻ”ĮņĖįµÄŹŌ¹Ü |
| ĶŹÉ«Ź±¼ä | 100 s | 90 s |
| ŹŌ ¹Ü | µĪČė10µĪĻ”ĮņĖįµÄŹŌ¹Ü | ¼ÓČė1 mLĻ”ĮņĖįµÄŹŌ¹Ü | ¼ÓČė2 mLĻ”ĮņĖįµÄŹŌ¹Ü |
| ĶŹÉ«Ź±¼ä | 70 s | 100 s | 120 s |

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗµ„Ń”Ģā
³£ĪĀĻĀ£¬Na2CO3ČÜŅŗÖŠ“ęŌŚĘ½ŗā£ŗCO32£+H2O HCO3£+OH££¬ĻĀĮŠÓŠ¹ŲøĆČÜŅŗµÄĖµ·ØÕżČ·µÄŹĒ
HCO3£+OH££¬ĻĀĮŠÓŠ¹ŲøĆČÜŅŗµÄĖµ·ØÕżČ·µÄŹĒ
| A£®Ąė×ÓÅØ¶Č£ŗc(Na+)>c(CO32£)>c(OH£)>c(H+) | B£®ÉżøßĪĀ¶Č£¬Ę½ŗāĻņÓŅŅĘ¶Æ |
| C£®µĪČėCaCl2ÅØČÜŅŗ£¬ČÜŅŗµÄpHŌö“ó | D£®¼ÓČėNaOH¹ĢĢ壬ČÜŅŗµÄpH¼õŠ” |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com