
分析 ①根据溶度积常数计算各沉淀生成时所需银离子的浓度;
②计算出溴离子、碘离子浓度分别为1.0×10-5mol/L时银离子浓度,然后根据氯化银开始沉淀时银离子浓度进行比较,即可判断当AgC1沉淀开始析出时,溶液中的Br-、I-是否完全沉淀.
解答 解:①当生成AgBr沉淀时,所需银离子的浓度为:c(Ag+ )=$\frac{4.1×1{0}^{-15}}{0.1}$mol/L=4.1×10-14mol/l,
故答案为:4.1×10-14mo1/L;
②当生成AgCl沉淀时,所需银离子的浓度为:c(Ag+ )=$\frac{{K}_{sp}}{c(C{l}^{-})}$=$\frac{1.6×1{0}^{-10}}{0.1}$mol/L=1.6×10-9mol/l;
溶液中离子浓度小于1.0×10-5mol/L时,认为己沉淀完全;Br-沉淀完全时,溶液中Ag+浓度为:c(Ag+)=$\frac{4.1×1{0}^{-15}}{1×1{0}^{-5}}$mol/L=4.1×10-10mol/l<1.6×10-9mol/l,可见Br-已经完全沉淀;
I-离子完全沉淀时,溶液中银离子浓度为:c(Ag+)=$\frac{1.5×1{0}^{-16}}{1×1{0}^{-5}}$mol/L=1.5×10-11mol/l<1.6×10-9mol/l,可见I-已经完全沉淀,
故答案为:是.
点评 本题考查难溶电解质的溶解平衡及沉淀转化的本质,题目难度中等,明确溶解平衡及其影响因素为解答关键,注意掌握溶度积的概念及表达式,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | CaO+H2O═Ca(OH)2 | B. | CO2+C $\frac{\underline{\;高温\;}}{\;}$ 2CO | ||
| C. | CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O | D. | NaOH+HCl═NaCl+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
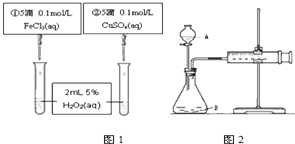
| A. | 图1实验可通过观察产生气泡快慢来比较反应速率的大小 | |
| B. | 若图1所示实验中反应速率为①>②,则一定说明Fe3+比Cu2+对H2O2分解催化效果好 | |
| C. | 用图2装置可测定反应产生的气体体积 | |
| D. | 为检查图2装置的气密性,可关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向0.10mol•L-1NH4HCO3溶液中通入CO2:c(NH4+)=c(HCO3-)+c(CO32-) | |
| B. | 0.10mol•L-1CH3COONa溶液中通入HCl:c(Na+)>c(Cl-)>c(CH3COOH) | |
| C. | 0.10mol•L-1Na2SO3溶液通入SO2:c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)] | |
| D. | 向0.10mol•L-1NaHSO3溶液中通入NH3:c(Na+)>c(SO32-)>c(NH4+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
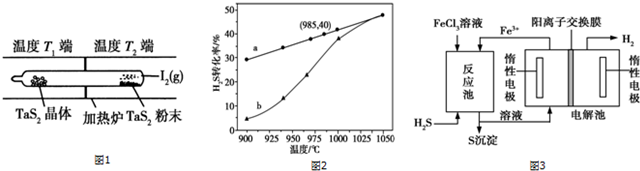
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
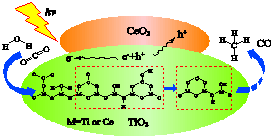 2016年3月新疆理化技术研究所首先发现:在光、碱性CeO2修饰TiO2的复合纳米材料的催化作用下,二氧化碳和水可转化为甲烷和一氧化碳.下列说法不正确的是( )
2016年3月新疆理化技术研究所首先发现:在光、碱性CeO2修饰TiO2的复合纳米材料的催化作用下,二氧化碳和水可转化为甲烷和一氧化碳.下列说法不正确的是( )| A. | 此反应可将光能转化为化学能 | |
| B. | CO2和CH4均含极性共价键 | |
| C. | 产物可能还有O2 | |
| D. | CO2溶于水呈酸性的原因:CO2+H2O?H2CO3H2CO3?2H++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Z>G>M>Y | |
| B. | X、M形成的简单阴离子的还原性:X>M | |
| C. | G与Y形成的化合物一定既能与盐酸反应,又能与烧碱溶液反应 | |
| D. | X、Z分别与Y可形成原子数为1:1的物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸在水中电离:CH3COOH?H++CH3COO- | |
| B. | 乙烷和溴蒸气的混合物光照后发生反应:CH3CH3+Br2$\stackrel{光}{→}$CH3CH2Br+HBr | |
| C. | 苯在浓硫酸并加热条件下与浓硝酸发生反应: +HNO3$→_{50~60℃}^{浓硫酸}$ +HNO3$→_{50~60℃}^{浓硫酸}$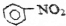 +H2O +H2O | |
| D. | 乙酸、乙醇和浓硫酸的混合物在加热条件下发生酯化反应:CH3COOH+CH3CH2OH$→_{△}^{催化剂}$CH3COOCH2CH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com