
| A. | 通入Ne | B. | 通入NO2 | C. | 通入N2O4 | D. | 以上都不行 |
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:解答题
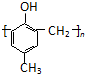 )的合成路线如下:
)的合成路线如下: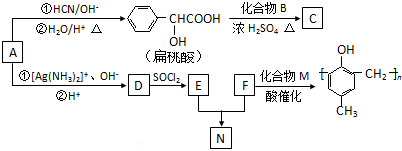
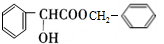 .
. .
. )有多种同分异构体.属于甲酸酯且含酚羟基的同分异构体有13种,写出其中一个含亚甲基(-CH2-)的同分异构体的结构简式
)有多种同分异构体.属于甲酸酯且含酚羟基的同分异构体有13种,写出其中一个含亚甲基(-CH2-)的同分异构体的结构简式 (任意一种).
(任意一种).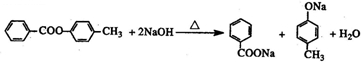 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 悬挂在干燥的环境中 | B. | 经常清扫表面的灰尘可以防止生锈 | ||
| C. | 表面涂漆防止生锈 | D. | 生锈时主要生成四氧化三铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
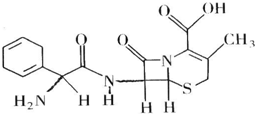 头孢拉定片(Cefradine Tablets),又称先锋,其结构式如图所示,有关该物质的描述正确的是( )
头孢拉定片(Cefradine Tablets),又称先锋,其结构式如图所示,有关该物质的描述正确的是( )| A. | 分子式为C16H20N3O4S | |
| B. | 该物质在一定条件下能发生水解 | |
| C. | 该有机物质属于芳香族化合物 | |
| D. | 该物质不能与NaHCO3溶液反应放出CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用10%的盐酸蒸发浓缩获得30%的盐酸 | |
| B. | 水晶项链和餐桌上的瓷盘都是硅酸盐制品 | |
| C. | 二氧化硫具有漂白性,与氯水混合使用效果更好 | |
| D. | 可利用丁达尔效应来区别淀粉溶液和氯化钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 现象 | 结论 |
| A | Cl2、SO2分别通入紫色石蕊溶液中,溶液均褪色 | 二者均有漂白性 |
| B | CO2、SO2分别通入Ba(NO3)2溶液中,均无沉淀生成 | 弱酸不能制强酸 |
| C | 向溶液中滴加盐酸,产生的气体通入澄清石灰水中,石灰水变浑浊 | 该溶液中一定有CO32- |
| D | 将钾、钠分别放入装有煤油的试管中,二者均下沉到试管底部 | 钾、钠的密度都比煤油大 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
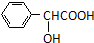
 NH2+CHCOOH$\stackrel{△}{?}$
NH2+CHCOOH$\stackrel{△}{?}$
 +H2O
+H2O| 名称 | 相对分子质量 | 性状 | 密度/(g/cm3) | 熔点/℃ | 沸点/℃ | 溶解度 | |
| 苯胺 | 93 | 无色油状液体具有还原性 | 1.02 | -6.1 | 184 | 微溶于水 | 均易溶于乙醇、乙醚 |
| 乙酸 | 60 | 无色液体 | 1.05 | 16.5 | 118 | 易溶于水 | |
| 乙酰 苯胺 | 135 | 白色晶体 | 1.22 | 114 | 304 | 微溶于冷水,溶于热水 | |
 ,
,查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com