


科目:高中化学 来源:不详 题型:单选题

| A.N4属于一种新型的化合物 | B.N4是N2的同系物 |
| C.N4转变为N2是物理变化 | D.1molN4气体转变为N2放出724kJ能量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.-386kJ·mol-1 | B.+386kJ·mol-1 | C.- | D.+746kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.H2O ( g ) = H2 ( g ) + 1/2O2 ( g )△H =" +242" kJ/mol |
| B.2H2 ( g ) + O2 ( g ) = 2H2O ( l )△H = -484 kJ/mol |
| C.H2 ( g ) + 1/2O2 ( g ) = H2O ( g )△H =" +242" kJ/mo |
| D.2H2 ( g ) + O2 ( g ) = 2H2O ( g )△H =" +484" kJ/mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.S的燃烧热为297.23kJ/mo1 |
| B.S(g)+O2(g)===SO2(g)放出的热量大于297.23kJ |
| C.S(g)+O2(g)==SO2(g)放出的热量小于297.23kJ |
| D.形成1mol SO2(g)的化学键所释放的总能量大于断裂1molS(s)和lmolO2(g)的化学键所吸收的总能量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
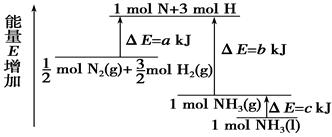
| A.N2(g)+3H2(g)===2NH3(l) ΔH=2(a-b-c)kJ·mol- |
| B.N2(g)+3H2(g)===2NH3(g) ΔH=2(b-a)kJ·mol-1 |
| C.1/2 N2 (g)+3/2H2(g)===NH3(l) ΔH=(b+c-a)kJ·mol-1 |
| D.1/2 N2(g)+3/2H2(g)===NH3(g) ΔH=(a+b)kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.H2(g)+Cl2(g)="2HCl(g)" ΔH=-183 kJ/mol |
| B.1/2H2(g)+1/2Cl2(g)="HCl(g)" ΔH=-124kJ/mol |
| C.2HCl(g)=H2(g)+Cl2(g) ΔH=-248 kJ/mol |
| D.HCl(g) =1/2H2(g)+1/2Cl2(g) ΔH=-91.5 kJ/mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.奥运火炬燃烧时的能量转化主要是由化学能转变为热能 |
| B.相同条件下,正丁烷的热值比丙烷大 |
| C.正丁烷比异丁烷不稳定 |
| D.异丁烷分子中的碳氢键比正丁烷的多 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3OH(g); ΔH1
CH3OH(g); ΔH1 CH3OH(g) +H2O(g);ΔH2
CH3OH(g) +H2O(g);ΔH2| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com