
| A. | 减小NH3的浓度 | B. | 降低反应体系的温度 | ||
| C. | 降低压强 | D. | 缩小容器体积 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 固体的溶解过程与焓变有关 | |
| B. | 温度、压强一定时,放热的熵增加反应不一定能自发进行 | |
| C. | 反应焓变是决定反应能否自发进行的唯一因素 | |
| D. | 在温度、压强一定的条件下,焓因素和熵因素共同决定一个化学反应的方向 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它们都含有碳、而且碳原子有四个价电子,碳原子间以及碳与其他原子间结构多样 | |
| B. | 它们反应很复杂 | |
| C. | 制取它们的方法很多 | |
| D. | 它们都是非电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
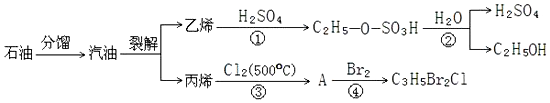
| A. | 石油分馏和裂解均属于化学变化 | |
| B. | 反应①②表明硫酸可用于乙烯水化法制乙醇的催化剂 | |
| C. | 反应①与反应④均属于加成反应 | |
| D. | 反应③的原子利用率为100% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,说法正确的是( )
,说法正确的是( )| A. | 贝诺酯分子中有三种含氧官能团 | |
| B. | 可用FeCl3溶液区别乙酰水杨酸和对乙酰氨基酚 | |
| C. | 乙酰水杨酸和对乙酰氨基酚均能与NaHCO3溶液反应 | |
| D. | 贝诺酯与足量NaOH溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 编号 | 温度(℃) | 起始物质的量 (mol) | 平衡物质的量 (mol) | 达到平衡所需时间 (s) | |
| PCl5(g) | PCl3(g) | Cl2(g) | |||
| Ⅰ | 320 | 0.40 | 0.10 | 0.10 | 2 |
| Ⅱ | 320 | 0.80 | t1 | ||
| Ⅲ | 410 | 0.40 | 0.15 | 0.15 | t2 |
| A. | 平衡常数K:容器Ⅱ>容器Ⅲ | |
| B. | 反应到达平衡时,容器Ⅱ中PCl5的转化率小于25% | |
| C. | 反应到达平衡时,容器I中的平均速率为v(PCl5)=0.05mol•L-1•s-1 | |
| D. | 起始时向容器Ⅲ中充入0.30molPCl5、0.45molPCl3和0.10molCl2,则反应将向逆反应方向进行 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com