
| A. | 金属钠与水反应:Na+2H2O=Na++2OH-+H2↑ | |
| B. | Cu与浓硝酸反应制NO2:Cu+4HNO3(浓)=Cu2++2NO3-+2NO2↑+2H2O | |
| C. | 向Na2SiO3溶液中通入过量CO2:SiO32-+CO2+H2O═H2SiO3↓+CO32- | |
| D. | 将NaHSO4与Ba(OH)2溶液混合至中性:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O |
分析 A.2mol钠与水反应生成1mol氢气,该反应不满足电子守恒、电荷守恒;
B.浓硝酸中的硝酸在离子方程式中应该拆开;
C.二氧化碳过量,反应生成硅酸和碳酸氢根离子,不是碳酸根离子;
D.反应后混合液为中性,则硫酸氢钠与氢氧化钡按照2:1反应.
解答 解:A.金属钠与水反应生成氢氧化钠和氢气,正确的离子方程式为:2Na+2H2O=2Na++2OH-+H2↑,故A错误;
B.Cu与浓硝酸反应制NO2,浓硝酸中的硝酸分子应该拆开,正确的离子方程式为:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O,故B错误;
C.向Na2SiO3溶液中通入过量CO2,反应生成碳酸氢根离子,正确的离子方程式为:SiO32-+2CO2+2H2O═H2SiO3↓+2HCO3-,故C错误;
D.NaHSO4与Ba(OH)2溶液混合至中性,氢离子与氢氧根离子的物质的量相等,反应的离子方程式为:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O,故D正确;
故选D.
点评 本题考查了离子方程式的判断,为高考的高频题,题目难度不大,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)等.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:选择题
| A. | 向0.1mol/L、pH=1的NaHA溶液中加入NaOH溶液:HA-+OH-═A2-+H2O | |
| B. | 标准状况下,将1.12LCO2气体通入1L0.1mol/L的NaAlO2溶液中:CO2+2H2O+AlO2-═Al(OH)3↓+HCO3- | |
| C. | 由水电离出的c(H+)=1×10-12mol/L的溶液中可能大量存在K+、I-、Mg2+、NO3- | |
| D. | 向NH4Al(SO4)2溶液中滴加Ba(OH)2溶液使SO42-完全沉淀:NH4++Al3++2SO42-+2Ba2++4OH-═NH3•H2O+Al(OH)3↓+2BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 “8•12”天津港危化仓库爆炸,造成生命、财产的特大损失.据查危化仓库中存有大量的钠、钾、白磷(P4)、硝酸铵和氰化钠(NaCN).请回答下列问题:
“8•12”天津港危化仓库爆炸,造成生命、财产的特大损失.据查危化仓库中存有大量的钠、钾、白磷(P4)、硝酸铵和氰化钠(NaCN).请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
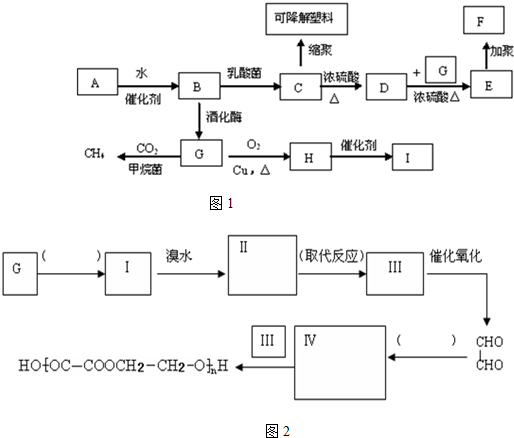
 六元环状化合物I
六元环状化合物I
 .
. 的合成路线如图2:(按要求填写,消去反应;氧化反应内填写反应类型,内填写Ⅱ和Ⅳ的结构简式)
的合成路线如图2:(按要求填写,消去反应;氧化反应内填写反应类型,内填写Ⅱ和Ⅳ的结构简式)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol羟基( )中含有的电子数为0.7 NA )中含有的电子数为0.7 NA | |
| B. | 1 L 0.1 mol•L-1的AlCl3 溶液中含有Al3+的数目为0.1 NA | |
| C. | 0.1 mol N2与足量H2反应,转移的电子数为0.6 NA | |
| D. | 标准状况下,1.12 L HCHO中C原子的数目为0.05 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 德国化学家维勒第一次人工合成了尿素,从而揭开了人工合成有机物的序幕 | |
| B. | 中国化学家侯德榜成功发明了侯氏制碱法,打破了外国当时对中国的相关技术封锁 | |
| C. | 英国科学家卢瑟福根据α粒子散射实验提出了“葡萄干面包式”原子结构模型 | |
| D. | 俄国化学家门捷列夫在前人基础上研究提出了元素周期律并列出了第一张元素周期表 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用Cu作阳极电解饱和食盐水:Cu+2H+$\frac{\underline{\;电解\;}}{\;}$Cu2++H2↑ | |
| B. | Fe3O4溶于氢碘酸溶液中:Fe3O4+8H++2I-=3Fe2++I2+4H2O | |
| C. | NH4Al(SO4)2溶于过量的浓Ba(OH)2溶液中:NH4++A13++2SO42-+2Ba2++5OH-=2BaSO4↓+AlO2-+NH3↑+H2O | |
| D. | 澄清石灰水中充入过量的SO2:SO2+OH-=HSO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径大小:Z>Y>X>W | |
| B. | 由W元素形成的单质一定是原子晶体,其熔沸点很高 | |
| C. | W、Y、Z三种元素形成的气态氢化物中最稳定的是Z的气态氢化物 | |
| D. | Y、Z所形成的氧化物的水化物的酸性为:Y<Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.8g铁粉与50mL 4mol•L-1盐酸反应,转移电子的数目为0.15NA | |
| B. | 常温常压下,NA个CO2分子占有的体积为22.4L | |
| C. | 常温常压下,16g O2和O3混合气体中含有的氧原子数为NA | |
| D. | 1mol•L-1 AlCl3溶液中含有的Cl-数目为3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com