
A.纯H2O中的H2O分子之间
B.液态HF中的HF分子之间
C.NH3·H2O分子中的NH3与H2O之间
D.可燃冰CH4·nH2O中的CH4与H2O之间
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解
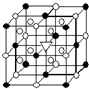 A.(1)右图所示为冰晶石(化学式为Na3AlF6)的晶胞.图中●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,▽图中●、○中的一种.图中●、○分别指代哪种粒子
A.(1)右图所示为冰晶石(化学式为Na3AlF6)的晶胞.图中●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,▽图中●、○中的一种.图中●、○分别指代哪种粒子| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| H2S | 187 | 202 | 2.6 |
| H2O2 | 272 | 423 | 以任意比互溶 |
| 80m-135n |
| 18n |
| 80m-135n |
| 18n |
查看答案和解析>>
科目:高中化学 来源: 题型:
不存在氢键的是
A.纯H2O中的H2O分子之间
B.液态HF中的HF分子之间
C.NH3·H2O分子中的NH3与H2O之间
D.可燃冰CH4·nH2O中的CH4与H2O之间
查看答案和解析>>
科目:高中化学 来源:2010年福建省八县(市)一中高一第二学期期末联考化学试卷 题型:填空题
(11分)有效地利用现有新能源和开发新能源已受到各国的重视。
(1)可用改进汽油组成的办法来改善汽油的燃烧性能。例如,在汽油中加入乙醇来生产“无铅汽油”。乙醇的分子式为C2H6O,试根据C、H、O成键的特点,写出C2H6O所有可能的结构式或结构简式 。
(2)天然气的主要的成分是甲烷,其燃烧产物无毒、热值高、管道输送方便,将成为我国西部开发的重点之一。能说明甲烷是正四面体而非正方形平面结构的理由是 。(填写编号)
①其一氯取代物不存在同分异构体 ②其二氯取代物不存在同分异构体
③其三氯取代物不存在同分异构体 ④其四氯取代物不存在同分异构体
(3)氢能是人类未来的理想能源。1980年我国首次制成一辆燃氢汽车,乘员12人,以50km/h 的速度行驶了40km。为了有效发展民用氢能源,首先必须制得廉价的氢气。下列既可行又经济的制氢方法是 (填写编号)
的速度行驶了40km。为了有效发展民用氢能源,首先必须制得廉价的氢气。下列既可行又经济的制氢方法是 (填写编号)
①电解水 ②锌和稀硫酸反应 ③光解海水
其次,制得纯氢气后,还需要解决的问题是 。(写出其中的一个) (4)今有两个氢气燃烧生成水的热化学方程式
(4)今有两个氢气燃烧生成水的热化学方程式 2H2(g)+ O2(g) ="=" 2H2O(g) △H=a kJ/mol
2H2(g)+ O2(g) ="=" 2H2O(g) △H=a kJ/mol 2H2(g)+ O2(g) ==2H2O(l) △H=b kJ/mol
2H2(g)+ O2(g) ==2H2O(l) △H=b kJ/mol
请回答下列问题:(提示:︱b︱表示b的绝对值) ①若2 molH2完全燃烧生成水蒸气,则放出的热量 (填“>”、“<”或“=”)︱b︱kJ
①若2 molH2完全燃烧生成水蒸气,则放出的热量 (填“>”、“<”或“=”)︱b︱kJ
② 若已知拆开1mol氢气中的化学键要消耗436 kJ能量,拆开1mol氧气中的化学键要
若已知拆开1mol氢气中的化学键要消耗436 kJ能量,拆开1mol氧气中的化学键要 消耗496kJ能量,水蒸气中1molH—O键形成时放出热量463kJ,写出该反应的热化学方程式:
消耗496kJ能量,水蒸气中1molH—O键形成时放出热量463kJ,写出该反应的热化学方程式:

查看答案和解析>>
科目:高中化学 来源:2015届福建省高二上学期期中考试化学试卷(解析版) 题型:选择题
氮元素可以形成多种分子和离子,如NH3、N2H4、N3-、NH4+、N2H62+等。回答以下问题:
(1)N的基态原子中,有 个运动状态不同的未成对电子。
(2)某元素原子与N3-含有相同的电子数,其基态原子的价电子排布式是_______。
(3)NH3、N2H4、NH4+、N2H62+四种微粒中,同种微粒间能形成氢键的有____________;不能作为配位体的有____________。
(4)纯叠氮酸HN3在常温下是一种液体,沸点较高,为308.8K,主要原因 是 。
(5)肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的另一种氮的氢化物。
①N2H4分子中氮原子的杂化类型是______。
②肼可用作火箭燃料,燃烧时发生的反应是:N2O4(l)+2N2H4(l)=3N2(g)+4H2O(g)
若该反应中有4 mol N—H键断裂,则形成的π键有________mol。
(6)肼能与硫酸反应生成N2H6SO4。N2H6SO4化合物类型与硫酸铵相同,则N2H6SO4 内微粒间作用力不存在_______(填标号)
a.离子键 b.共价键 c.配位键 d.范德华力
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com