
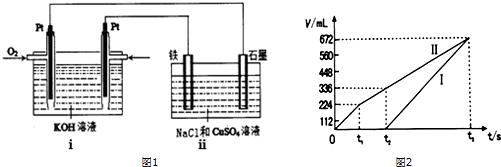
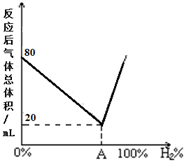
分析 本题的关健是对图象的解读.刚开始时阴极Cu2+得电子,无气体放出,Cu2+反应完溶液中的H+放电,Ⅰ是H2,阳极先是溶液中的Cl-放电,反应完后溶液中的OH-放电,电解200mL一定浓度的NaCl与CuSO4混合溶液,阳极发生2Cl--2e-=Cl2↑、4OH--4e-=O2↑+2H2O,阴极发生Cu2++2e-=Cu、2H++2e-=H2↑,结合图可知,Ⅰ为阴极气体体积与时间的关系,Ⅱ为阳极气体体积与时间的关系,计算时抓住电子守恒.
解答 解:图1中乙中石墨电极为阳极、铁电极为阴极,开始Cl-在阳极放电生成氯气,阴极Cu2+放电生成Cu:Cu2++2e-=Cu;电解200mL一定浓度的NaCl与CuSO4混合溶液,阳极发生2Cl--2e-=Cl2↑、4OH--4e-=O2↑+2H2O,阴极发生Cu2++2e-=Cu、2H++2e-=H2↑,结合图可知,Ⅰ为阴极气体体积与时间的关系,Ⅱ为阳极气体体积与时间的关系①由图可知,产生氯气为224mL,则由2Cl--2e-=Cl2↑可知,n(NaCl)=$\frac{0.224L}{22.4L/mol}$×2=0.02mol,所以c(NaCl)=$\frac{0.02mol}{0.2L}$=0.1mol/L,由t2时生成氧气为112mL,n(O2)=$\frac{0.112L}{22.4L/mol}$=0.005mol,则共转移电子为0.02mol+0.005mol×4=0.04mol,根据电子守恒及Cu2++2e-=Cu可知,n(CuSO4)=$\frac{0.04mol}{2}$=0.02mol,所以c(CuSO4)=$\frac{0.02mol}{0.2L}$=0.1mol/L.
故答案为:Cu2++2e-=Cu;0.1mol/L;0.1mol/L.
点评 本题考查电解原理,明确发生的电极反应及图图象的对应关系是解答本题的关键,注意把握电极反应式的书写,为解该题的关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
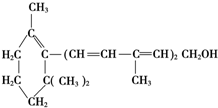
| A. | 维生素A中含有苯环 | |
| B. | 维生素A具有环己烷的结构单元 | |
| C. | 维生素A的一个分子中含有三个双键 | |
| D. | 维生素A的一个分子中含有30个氢原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4.6g 由NO2和N2O4组成的混合气体中含有的原子总数为0.3NA | |
| B. | 7.4g 丁醇中存在的共价键总数为1.3NA | |
| C. | 铁与稀硝酸反应时,生产0.1mol NO转移的电子数为0.3NA | |
| D. | 0.2 g $D_2^{16}O$中含有的质子数,中子数,电子数均为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
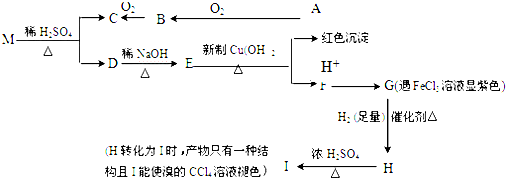
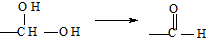
 ;②H→I:
;②H→I: .
. .
.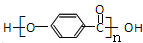 .
. 等.(任写一种)
等.(任写一种)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化石燃料蕴藏的能量来自远古时期生物体所吸收利用的太阳能 | |
| B. | 光-热转化是目前技术最成熟、成本最低廉、应用最广泛的利用太阳能形式 | |
| C. | 氢气之所以被称为“绿色能源”是因为它燃烧的产物不会污染环境 | |
| D. | 人类利用的能源都是通过化学反应获得的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在蒸发皿中灼烧CuSO4•5H2O晶体以除去结晶水 | |
| B. | 配制0.1 mol•L-1硫酸溶液时,容量瓶应先用0.1 mol•L-1硫酸溶液润洗 | |
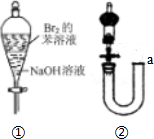
| C. | 用图①所示装置实验,振荡后静置,溶液不再分层,且保持无色透明 | |
| D. | 沿图②中的a口加水,可以检验该装置的气密性. |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ①某烷烃分子式为C6H14,若该烷烃可由两种炔烃与氢气加成得到,则该烷烃的结构简式为(CH3)2CHCH2CH2CH3.
①某烷烃分子式为C6H14,若该烷烃可由两种炔烃与氢气加成得到,则该烷烃的结构简式为(CH3)2CHCH2CH2CH3.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com