
| X | Y | |||
| Z | W | Q |
| A. | X与Y可形成的化合物在5种以上 | |
| B. | 工业上常常通过电解Z的熔融氧化物的方法来获得Z的单质 | |
| C. | 这五种元素形成的简单离子的半径由大到小为:W>Q>X>Y>Z | |
| D. | W、Q两种元素形成的化合物每种原子最外层都达到了8e-稳定结构 |
分析 这几种元素都是短周期元素,根据元素在周期表中的位置知,X、Y位于第二周期,Z、W、Q位于第三周期,W原子的质子数是其M层电子数的三倍,设其M层电子为x,则W原子质子数=2+8+x,2+8+x=3x,所以x=5,为P元素,则X是N、Y是O、Z是Al、Q是Cl元素;
A.X、Y分别是N、O元素,二者能形成多种氮氧化物;
B.Z是Al元素,工业上采用电解熔融氧化铝的方法冶炼Al;
C.电子层数越多其离子半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小;
D.W和Q两种元素形成的化合物为PCl3、PCl5.
解答 解:这几种元素都是短周期元素,根据元素在周期表中的位置知,X、Y位于第二周期,Z、W、Q位于第三周期,W原子的质子数是其M层电子数的三倍,设其M层电子为x,则W原子质子数=2+8+x,2+8+x=3x,所以x=5,为P元素,则X是N、Y是O、Z是Al、Q是Cl元素;
A.X、Y分别是N、O元素,二者能形成多种氮氧化物,如N2O、NO、NO2、N2O4、N2O5,所以X与Y可形成的化合物在5种以上,故A正确;
B.Z是Al元素,铝性质较活泼,熔融状态下氯化铝不导电,所以工业上采用电解熔融氧化铝的方法冶炼Al,故B正确;
C.电子层数越多其离子半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小,所以离子半径:W>Q>X>Y>Z,故C正确;
D.W和Q两种元素形成的化合物为PCl3、PCl5,在主族元素形成的ABn型化合物中,对于共价化合物元素化合价绝对值+元素原子的最外层电子层=8,则该元素原子满足8电子结构,PCl3中P元素化合价为+3价,P原子最外层电子数是5,3+5=8,则P原子满足8电子结构,Cl元素化合价绝对值为1,其最外层电子数是7,1+7=8,则Cl原子满足8电子结构;
PCl5中P元素化合价为+5价,P原子最外层电子数是5,5+5=10,则P原子不满足8电子结构,
故D错误;
故选D.
点评 本题考查原子结构和元素周期律,为高频考点,涉及金属冶炼、8电子稳定结构判断、离子半径大小比较等知识点,明确原子结构、物质结构及物质性质是解本题关键,注意铝的冶炼方法,为易错点.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:填空题
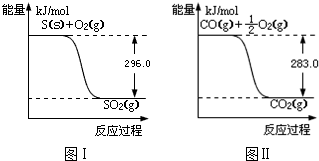
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KMnO4溶液 | B. | KSCN溶液 | C. | NaOH溶液 | D. | NH3•H2O溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测溶液A的体积(mL) | KMnO4标准溶液的体积 | |
| 滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
| 第一次 | 20.00 | 0.10 | 20.12 |
| 第二次 | 20.00 | 2.20 | 24.20 |
| 第三次 | 20.00 | 4.30 | 24.28 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
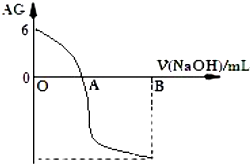
| A. | A 点时加入氢氧化钠溶液体积为 20 mL | |
| B. | OA 段溶液中:c(CH3COO-)>c(CH3COOH) | |
| C. | 室温时 0.01 mol/L的醋酸溶液 pH=4 | |
| D. | 若 B 点时加入 NaOH 溶液为 40 mL,所得溶液中:c(CH3COO-)+c(CH3COOH)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(HCN)>c(CN-) | B. | c(Na+)<c(CN-) | ||
| C. | c(HCN)-c(CN-)=c(OH-) | D. | c(HCN)+c(CN-)=2 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

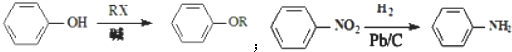

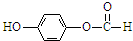 、
、 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com