
| A、硫酸溶液与硝酸钾溶液混合 |
| B、氯酸钾与二氧化锰混合后加热 |
| C、铁与稀硫酸 |
| D、氢气与氧气混合后点燃 |
| ||
| ||


 高效智能课时作业系列答案
高效智能课时作业系列答案科目:高中化学 来源: 题型:
 )中三个氢原子都可以跟重水(D2O)中氘原子发生交换,又知次磷酸(H3PO2)也能跟D2O进行氢交换,次磷酸钠(NaH2PO2)却不能再跟D2O发生氢交换,由此推断出次磷酸分子的结构是( )
)中三个氢原子都可以跟重水(D2O)中氘原子发生交换,又知次磷酸(H3PO2)也能跟D2O进行氢交换,次磷酸钠(NaH2PO2)却不能再跟D2O发生氢交换,由此推断出次磷酸分子的结构是( )A、 |
B、 |
C、 |
D、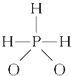 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
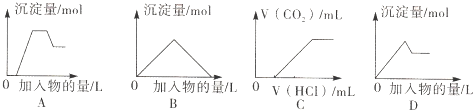
| A、图A表示向含H+、Mg2+、Al3+、NH4+的溶液中滴加NaOH溶液产生沉淀摄的关系曲线 |
| B、图B表示向澄清石灰水中通入二氧化碳直至过量产生沉淀量的关系曲线 |
| C、图C表示向NaOH和Na2CO3的混合液中滴加盐酸产生CO2气体的关系曲线 |
| D、图D表示向明矾溶液中滴加Ba(OH)2溶液产生沉淀最的关系曲线 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 操 作 | 现 象 | 结 论 | |
| (1) | 取少量该溶液于试管中, 滴加无色酚酞溶液 | 该溶液显碱性 | |
| (2) | 另取少量该溶液于试管中,滴加稀盐酸 | 有气泡产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 X、Y、Z、W均为常见的烃的含氧衍生物且物质类别不同,它们之间存在如图所示的转化关系.下列判断正确的是( )
X、Y、Z、W均为常见的烃的含氧衍生物且物质类别不同,它们之间存在如图所示的转化关系.下列判断正确的是( )| A、X是羧酸,Y是酯 |
| B、Z是醛,W是羧酸 |
| C、Y是醛,W是醇 |
| D、X是醇,Z是酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com