
 铁和铁的化合物在工业生产和日常生活中都有广泛的用途.请回答下列问题:
铁和铁的化合物在工业生产和日常生活中都有广泛的用途.请回答下列问题:
| ||
| 充电 |


 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源:2012届重庆市高三考前模拟测试理科综合试题化学试卷(带解析) 题型:填空题
(15分)铁和铁的化合物在工业生产和日常生活中都有广泛的用途,请回答下列问题:
(1)铁元素在周期表中的位置是 。
(2)写出Fe与稀硫酸反应的离子方程式 。
(3)已知:Fe2O3(s)+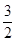 C(s)=
C(s)=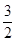 CO2(g)+2Fe(s);△H=+234.1kJ/mol
CO2(g)+2Fe(s);△H=+234.1kJ/mol
C(s)+O2(g)=CO2(g); △H=-393.5kJ/mol.
请写出Fe(s)与O2(g)反应生成Fe2O3(s)的热化学方程式 。
(4)在一定条件下,氧化铁可以与一氧化碳发生下列反应:
Fe2O3(s)+3CO(g)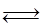 2Fe(s)+3CO2(g);工业上有16 t Fe2O3在200m3的容器中反应,l小时后测得Fe2O3的转化率为50%,则这段时间内CO的消耗速率为 mol/(L·h).
2Fe(s)+3CO2(g);工业上有16 t Fe2O3在200m3的容器中反应,l小时后测得Fe2O3的转化率为50%,则这段时间内CO的消耗速率为 mol/(L·h).
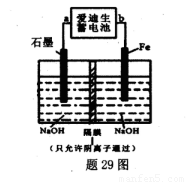
(5)爱迪生蓄电池的反应式为:Fe+NiO2+2H2O Fe(OH)2+Ni(OH)2;高铁酸钠( Na2FeO4)是一种新型饮水消毒剂.用题29图装置可以制取少量高铁酸钠.
Fe(OH)2+Ni(OH)2;高铁酸钠( Na2FeO4)是一种新型饮水消毒剂.用题29图装置可以制取少量高铁酸钠.
①此装置中爱迪生蓄电池的负极是____(填“a”或"b”).
②写出阳极的电极反应式________.
③当制得132.8g高铁酸钠时,阳极区减少的阴离子的物质的量为 .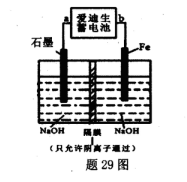
查看答案和解析>>
科目:高中化学 来源:2013-2014学年福建省莆田市高三3月质量检测化学试卷(解析版) 题型:填空题
(13分)铁和铁的化合物在工业生产和日常生活中都有广泛的用途。
(1)在定向爆破中,常利用氧化铁与铝反应放出的热量来切割钢筋,该反应的化学方程式为__。
(2)已知:2Fe2O3(s)+3C(s)=3CO2(g)+4Fe(s)? △H=+468.2 kJ·mol-1
C(s)+O2(g)=CO2(g) △H=-393.5 kJ·mol-1。
则Fe(s)与O2 (g)反应生成Fe2 O3 (s)的热化学方程式为______________________。
(3)可用KMnO4溶液滴定Fe2+的浓度,反应的离子方程式如下:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
①KMnO4溶液应盛放在_____滴定管中;
②判断达到滴定终点的现象是_____;
③用硫酸酸化的0.020 00 mol·L-1。KMnO4溶液滴定某FeSO4溶液至终点,实验数据记录如下表:
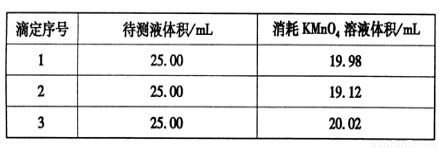
请分析数据并计算,该FeSO4溶液的物质的量浓度为_____。
(4)新型纳米材料ZnFe2Ox,可用于除去工业废气中的某些氧化物。制取新材料和除去废气的转化关系如下图:
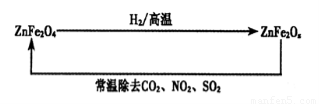
①已知ZnFe2O4与H2反应的物质的量之比为2:1,则ZnFe2Ox中x=_____;
②用ZnFe2Ox除去SO2的过程中,氧化剂是_____。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年重庆市高三考前模拟测试理科综合试题化学试卷(解析版) 题型:填空题
(15分)铁和铁的化合物在工业生产和日常生活中都有广泛的用途,请回答下列问题:
(1)铁元素在周期表中的位置是 。
(2)写出Fe与稀硫酸反应的离子方程式 。
(3)已知:Fe2O3(s)+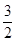 C(s)=
C(s)=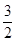 CO2(g)+2Fe(s);△H=+234.1kJ/mol
CO2(g)+2Fe(s);△H=+234.1kJ/mol
C(s)+O2(g)=CO2(g); △H=-393.5kJ/mol.
请写出Fe(s)与O2(g)反应生成Fe2O3(s)的热化学方程式 。
(4)在一定条件下,氧化铁可以与一氧化碳发生下列反应:
Fe2O3(s)+3CO(g)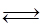 2Fe(s)+3CO2(g);工业上有16 t Fe2O3在200m3的容器中反应,l小时后测得Fe2O3的转化率为50%,则这段时间内CO的消耗速率为 mol/(L·h).
2Fe(s)+3CO2(g);工业上有16 t Fe2O3在200m3的容器中反应,l小时后测得Fe2O3的转化率为50%,则这段时间内CO的消耗速率为 mol/(L·h).
(5)爱迪生蓄电池的反应式为:Fe+NiO2+2H2O Fe(OH)2+Ni(OH)2;高铁酸钠( Na2FeO4)是一种新型饮水消毒剂.用题29图装置可以制取少量高铁酸钠.
Fe(OH)2+Ni(OH)2;高铁酸钠( Na2FeO4)是一种新型饮水消毒剂.用题29图装置可以制取少量高铁酸钠.
①此装置中爱迪生蓄电池的负极是____(填“a”或"b”).
②写出阳极的电极反应式________.
③当制得132.8g高铁酸钠时,阳极区减少的阴离子的物质的量为 .
查看答案和解析>>
科目:高中化学 来源:2012-2013学年黑龙江省哈尔滨六中高三(上)期中化学试卷(解析版) 题型:解答题
 Fe(OH)2+Ni(OH)2;高铁酸酸钠(Na2FeO4)是一种新型净水剂.用下面装置可以制取少量高铁酸钠.
Fe(OH)2+Ni(OH)2;高铁酸酸钠(Na2FeO4)是一种新型净水剂.用下面装置可以制取少量高铁酸钠.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com