
| A. | CH4(g)+2O2(g)→CO2(g)+2H2O(g)+Q1 CH4(g)+$\frac{3}{2}$O2(g)→CO(g)+2H2O(g)+Q2 | |
| B. | S(s)+O2(g)→SO2(g)+Q1 S(g)+O2(g)→SO2(g)+Q2 | |
| C. | H2(g)+Br2(g)→2HBr(q)+Q1 H2(g)+Cl2(g)→2HCl(q)+Q2 | |
| D. | HCl(aq)+NaOH(aq)→NaCl(aq)+H2O(l)+Q1 CH3COOH(aq)+NaOH(aq)→CH3COONa(aq)+H2O(l)+Q2 |
分析 A.一氧化碳是碳单质不完全燃烧的产物,完全燃烧时生成二氧化碳,完全燃烧放热更多;
B.固体硫燃烧时要先变为气态硫,过程吸热;
C.Cl2比Br2活泼,放出的热量更多;
D.醋酸为弱酸,弱电解质的电离是吸热过程,酸越弱,发生中和反应放出的热量就越少.
解答 解:A.可以很容易地判断出来第一个是完全燃烧反应,第二个是不完全燃烧反应,那么放出的热量很明显是完全燃烧比不完全燃烧放出的多,所以Q1>Q2,故A错误;
B、固体硫燃烧时要先变为气态硫,过程吸热,气体与气体反应生成气体比固体和固体反应生气气体产生热量多,所以Q2>Q1,故B正确;
C.Cl2比Br2活泼,Cl-Cl键能较大,放出的热量更多,所以Q2>Q1,故C正确;
D.醋酸为弱酸,弱电解质的电离是吸热过程,酸越弱,发生中和反应放出的热量就越少,所以Q1>Q2,故D错误;
故选:BC.
点评 本题考查反应中热量大小比较,题目难度中等,本题注意反应的程度、物质的量以及物质的聚集状态不同,反应放出或吸收的热量是不同的.


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 胶体区别于其他分散系的本质特征是分散质的微粒直径在1-100nm之间 | |
| B. | 用平行光照射FeCl3溶液和Fe(OH)3胶体,可以加以区分 | |
| C. | 把FeCl3饱和溶液滴入到蒸馏水中,以制取Fe(OH)3胶体 | |
| D. | 下图图片显示的是树林中的晨曦,该现象与丁达尔现象有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②④ | C. | ①②③ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴加盐酸时,先产生沉淀又溶解 | |
| B. | 都能透过半透膜 | |
| C. | 加热、蒸干、灼烧,最终都有Fe2O3生成 | |
| D. | 都有丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
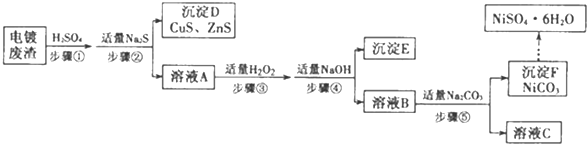
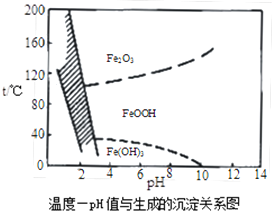
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0mol•L-1KNO3溶液:H+、Fe2+、Cl-、SO42- | |
| B. | pH=1的溶液:NH4+、Al3+、SO42-、Br- | |
| C. | 0.1 mol•L-1FeCl3溶液:NH4+、H+、I-、SCN- | |
| D. | 常温下,在c(H+)水•c(OH-)水=10-26的溶液中:K+、Fe2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(NH3)正=2v(CO2)逆 | B. | 密闭容器中总压强不变 | ||
| C. | 密闭容器中氨气的体积分数不变 | D. | 密闭容器中混合气体的密度不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | H+、Na+、A13+、Ag+、Ba2+ |
| 阴离子 | OH-、Cl-、CO32-、NO3、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaH+H2O═NaOH+H2↑ | B. | 2Na2O2+2H2O═4NaOH+O2↑ | ||
| C. | CaO+H2O═Ca(OH)2 | D. | 2F2+2H2O═4HF+O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com