
| A、兰色 | B、红色 | C、黄色 | D、橙色 |
| 0.0021mol-0.002mol |
| 5L |


 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案科目:高中化学 来源: 题型:
| A、先与Cl2加成,再与Br2加成 |
| B、先与Cl2加成,再与HBr加成 |
| C、先与HCl加成,再与HBr加成 |
| D、先与HCl加成,再与Br2加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、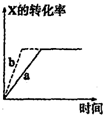 图所示反应:X(g)+Y(g)?2Z(g),b的压强一定比a大 |
B、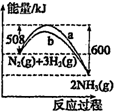 图表明合成氨反应是放热反应,b表示在反应体系中加入了催化剂 |
C、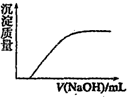 图表示向Ca(HCO3)2溶液中滴入NaOH溶液所得沉淀的质量变化 |
D、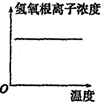 图表示明矾溶液受热时氢氧根浓度随温度的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、③④⑤⑦ | B、①②⑤⑥⑧ |
| C、③⑤⑥⑦ | D、①③⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol FeCl3与沸水反应生成胶体后,含有NA个Fe(OH)3胶粒 |
| B、25℃时,22.4 L甲烷含有的原子数为5NA |
| C、标准状况下,0.5NA个Cl2分子所占的体积为11.2 L |
| D、1.8 g重水(D2O)中含有的质子数为1.0NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
 ,它可通过不同的化学反应分别制得B、C、D和E四种物质.下列说法正确的是( )
,它可通过不同的化学反应分别制得B、C、D和E四种物质.下列说法正确的是( )
| A、A与E互为同分异构体 |
| B、C能使溴水褪色 |
| C、1 mol D与NaOH溶液反应,消耗NaOH的物质的量最多为3 mol |
| D、1 mol B最多能与5 mol H2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaOH |
| B、FeCl2 |
| C、NaHCO3 |
| D、FeCl3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com