
| A. | O原子采用SP2杂化 | B. | O原子采用SP3杂化 | ||
| C. | O原子采用SP杂化 | D. | 离子中存在非极性 |
分析 H3O+中氧原子含有3个共价单键和一个孤电子对,根据价层电子对互斥理论确定其空间构型,价层电子对数=σ 键个数+$\frac{1}{2}$(a-xb);H3O+是H+与H2O通过配位键形成;H3O+离子中不存在非极性键,存在的都是H-O极性共价键.
解答 解:H3O+中氧原子含有3个共价单键和一个孤电子对,水合氢离子中氢离子含有空轨道,氧原子含有孤电子对,所以二者形成一个配位键,结构式为: .
.
A.H3O+中,价层电子对数=3+$\frac{1}{2}$(6-1-3×1)=4,在H3O+中O原子成3个σ键,其中含有1个配位键,有一对未成键的孤对电子,杂化轨道数为4,采取sp3型杂化杂化,故A错误;
B.由A项分析可知O原子采用SP3杂化,故B正确;
C.由A项分析可知O原子采用SP3杂化,故C错误;
D.H3O+离子中不存在非极性键,存在的都是H-O极性共价键,故D错误.
故选:B.
点评 本题考查了杂化理论的应用、共价键的极性,题目难度不大,注意理解价层电子对互斥理论与杂化轨道理论,为高频考点.


科目:高中化学 来源: 题型:多选题
| A. | 铜锌原电池中铜是正极 | |
| B. | 用电解法精炼铜时粗铜作阴极 | |
| C. | 在电解饱和CuCl2溶液时,用铜作阳极 | |
| D. | 电解饱和食盐水时,用铜片作阳极 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
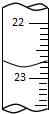 某化学实验小组用0.2000 mol/L的酸性KMnO4溶液测定草酸晶体的纯度(草酸晶体化学式为H2C2O4•2H2O,杂质不与KMnO4反应).实验步骤如下:
某化学实验小组用0.2000 mol/L的酸性KMnO4溶液测定草酸晶体的纯度(草酸晶体化学式为H2C2O4•2H2O,杂质不与KMnO4反应).实验步骤如下:| 滴定次数 | 草酸溶液体积 | 酸性KMnO4溶液体积 | |
| 滴定前读数/mL | 滴定后读数/mL | ||
| 第一次 | 25.00 | 0.20 | 20.58 |
| 第二次 | 25.00 | 4.00 | 24.40 |
| 第三次 | 25.00 | 2.38 | a |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 将氨通入盐酸中:NH3+H+=NH4+ | |
| B. | 在稀NaOH溶液中滴入几滴NH4Cl溶液:NH4++OH-=NH3↑+H2O | |
| C. | 将少量铜屑放入浓硝酸中:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O | |
| D. | 将稀硫酸滴在铜片上:Cu+2H+=Cu2++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 63.8 g | B. | 53.6 g | C. | 46.8 g | D. | 43.2 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X2+2Y2 ?2XY2 | B. | 2X2+Y2 ?2X2Y | C. | 3X2+Y2?2X3Y | D. | X2+3Y2?2XY3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
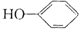 合成
合成 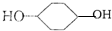
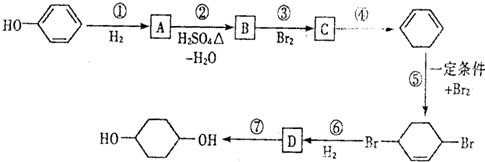
 ,D
,D .
.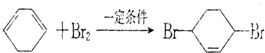 写出在同样条件下CH2=CH-CH=CH2与等物质的量Br2发生加成反应的化学反应方程式
写出在同样条件下CH2=CH-CH=CH2与等物质的量Br2发生加成反应的化学反应方程式 .
. 的反应方程式(有机物写结构简式,注明反应条件).
的反应方程式(有机物写结构简式,注明反应条件). .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③ | B. | ①② | C. | ③④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com