
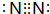 .
.分析 X、Y、Z、W、R是短周期元素,原子序数依次增大,Y的氧化物和R的氧化物均能形成酸雨,则Y为N元素、R为S元素;W和R是同周期相邻元素,则W为P元素;Y原子和Z原子的核外电子数之和为20,则Z原子核外电子数=20-7=13,则Z为Al;X原子核外各层电子数之比为1:2,X有2个电子层,可能为Li或C.
(1)Y为N元素,单质为N2,氮原子之间形成3对共用电子对;
(2)单质铜和稀硝酸反应生成硝酸铜、NO与水;
(3)原子半径越大,对核外电子越弱,得电子能力较弱;
(4)R的一种氧化物能使品红溶液褪色,该氧化物为SO2,工业上用氨气水溶液作该氧化物的吸收剂,足量的二氧化硫与氨水反应生成亚硫酸氢铵;
(5)N和Al组成的化合物AlN,工业上用氧化铝、碳、氮气在高温下制备,其中氧化铝和碳的物质的量之比为1:3,还生成CO.
解答 解:X、Y、Z、W、R是短周期元素,原子序数依次增大,Y的氧化物和R的氧化物均能形成酸雨,则Y为N元素、R为S元素;W和R是同周期相邻元素,则W为P元素;Y原子和Z原子的核外电子数之和为20,则Z原子核外电子数=20-7=13,则Z为Al;X原子核外各层电子数之比为1:2,X有2个电子层,可能为Li或C.
(1)Y为N元素,单质为N2,电子式为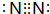 ,故答案为:
,故答案为: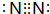 ;
;
(2)单质铜和稀硝酸反应生成硝酸铜、NO与水,反应的化学方程式为:8HNO3(稀)+3Cu═2NO↑+3Cu(NO3)2+4H2O,
故答案为:8HNO3(稀)+3Cu═2NO↑+3Cu(NO3)2+4H2O;
(3)P原子和S原子的电子层数相同,P原子半径较大,得电子能力较弱,故P的非金属性比元素S弱,
故答案为:P原子和S原子的电子层数相同,P原子半径较大,得电子能力较弱;
(4)R的一种氧化物能使品红溶液褪色,该氧化物为SO2,工业上用氨气水溶液作该氧化物的吸收剂,吸收剂与足量该氧化物反应的离子方程式:SO2+NH3•H2O═HSO3-+NH4+,
故答案为:SO2+NH3•H2O═HSO3-+NH4+;
(5)N和Al组成的化合物AlN,被大量用于制造电子元件.工业上用氧化铝、碳、氮气在高温下制备,其中氧化铝和碳的物质的量之比为1:3,说明还生成CO,则该反应的化学方程式为:Al2O3+3C+N2$\frac{\underline{\;高温\;}}{\;}$2AlN+3CO,
故答案为:Al2O3+3C+N2$\frac{\underline{\;高温\;}}{\;}$2AlN+3CO.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,侧重对化学用语的考查,(3)中注意理解同主族、同周期元素性质的相似性与递变性.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 14C的质量数为14g•mol-1 | B. | 14C与12C是两种不同的元素 | ||
| C. | 14C与C60互为同素异形体 | D. | 14C与14N中子数一定不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阴离子的还原性:W>Z | B. | 单质的沸点:W>Y | ||
| C. | 最高价氧化物的水化物的酸性:Y<Z | D. | 四种元素一定都是非金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
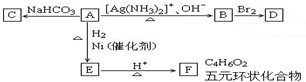 根据图示填空:(已知A分子式为${C_4}H_4^{\;}{O_3}$)
根据图示填空:(已知A分子式为${C_4}H_4^{\;}{O_3}$)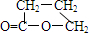 +H2O
+H2O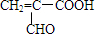
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
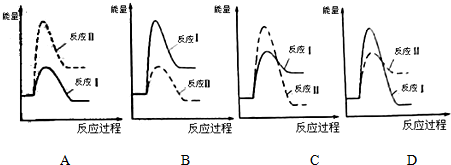
 Ba 2+(aq)+SO4 2-(aq)△H=+40KJ/mol.
Ba 2+(aq)+SO4 2-(aq)△H=+40KJ/mol.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
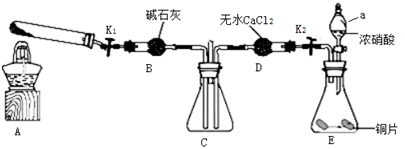
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
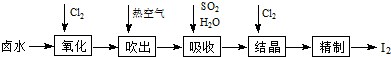
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com