

| A. | 铜片表面发生氧化反应 | B. | 电子从铜片流向锌片 | ||
| C. | 电流从锌片流向铜片 | D. | 锌片为负极铜片为正极 |
科目:高中化学 来源: 题型:解答题
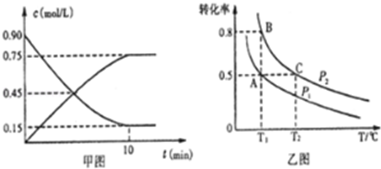
| 温度/℃ | 500 | 525 | 550 | 575 | 600 |
| 平衡转化率/% | 93.5 | 90.5 | 85.6 | 80.0 | 73.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Si→SiO2→H2SiO3→Na2SiO3 | B. | Al→Al2O3→Al(OH)3→NaAl(OH)4 | ||
| C. | N2→NH3→NO→NO2→HNO3→NO2 | D. | S→SO3→H2SO4→SO2→Na2SO3→Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向 NaOH 溶液中通入过量 C02:20H-+CO2=CO32-+H2O | |
| B. | 电解氯化镁溶液:2C1-+2H20$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+20H- | |
| C. | 向 H202 溶液中加入 Mn02:2H202+4H++Mn02=02↑+Mn2++4H20 | |
| D. | 向KAl(SO2)2溶液中滴加Ba(OH)2溶液至SO42-沉淀完全:Al3++2SO42-+2Ba2++40H-=A1O2-+2BaS04+2H20 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
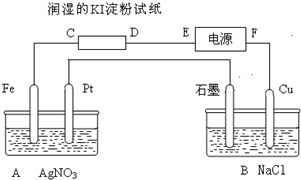 有电解装置如图所示.图中A装置盛1L 2mol/L AgNO3溶液.通电后,润湿的淀粉KI试纸的C端变蓝色,电解一段时间后试回答:
有电解装置如图所示.图中A装置盛1L 2mol/L AgNO3溶液.通电后,润湿的淀粉KI试纸的C端变蓝色,电解一段时间后试回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解液在电解质储罐和电池间不断循环.下列说法不正确的是( )
锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解液在电解质储罐和电池间不断循环.下列说法不正确的是( )| A. | 放电时左侧的电解质储罐中的离子总浓度增大 | |
| B. | 放电时负极的电极反应式为 Zn-2e-═Zn2+ | |
| C. | 充电时电极a为电源的负极 | |
| D. | 阳离子交换膜可阻止 Br2和Zn 直接发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu+H2SO4(浓) | B. | Cu+HNO3(浓) | C. | Fe+H2SO4(浓) | D. | C+H2SO4(浓) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
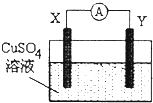
| A. | 若X为Fe,Y为Cu,则铁为正极 | |
| B. | 若X为Ag,Y为Cu,则电流表的指针不发生偏转 | |
| C. | 若X为Cu,Y为Zn,则锌片发生还原反应 | |
| D. | 若X为Fe,Y为C,则碳棒上有红色固体析出 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com