
(18分)钒(V)及其化合物广泛应用于工业催化、新材料和新能源等领域。
(1)V2O5是接触法制硫酸的催化剂。 ’
①已知25℃.10lkPa时:
2SO2(g)+O2(g)+2H2O(1)=2H2SO4(1) △H = -457kJ·mol-l
SO3(g)+H2O(1)=H2SO4(1) △H= -130kJ·mol-l
 则反应2SO2(g)+O2(g) 2SO3(g)的△H= kJ·mol-l。使用V2O5作催化剂后该反应逆反应的活化能 (填“增大”、“不变”或“减小”)。
则反应2SO2(g)+O2(g) 2SO3(g)的△H= kJ·mol-l。使用V2O5作催化剂后该反应逆反应的活化能 (填“增大”、“不变”或“减小”)。
②SO2水溶液可与SeO2反应得到硫酸,当有79gSe生成时,转移电子的物质的量为 mol,此反应的化学方程式是 。
(2)全钒液流电池的结构如图所示,其电解液中含有钒的不同价态的离子、H+和SO42-。电池放电时,负极的电极反应为:
V2+-e一=V3+。
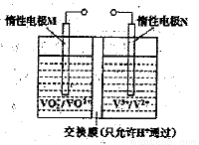
①电池放电时的总反应方程式为 。
充电时,电极M应接电源的 极。
②若电池初始时左、右两槽内均以VOSO4和H2SO4的混合液为电解液,使用前需先充电激活,充电过程阴极区的反应分两步完成:第一步VO2+转化为V3+;第二步V3+转化为V2+。则第一步反应过程中阴极区溶液n(H+) (填“增大”、“不变”或“减小”),阳极的电极反应式为: 。
(18分)
(1)①—197(2分) 减小(2分)
② 4(2分) 2SO2+SeO2+2H2O=2H2SO4+Se(2分)
(2)①VO2++V2++2H+=VO2++V3++H2O(3分) 正极(2分)
②减小(2分) VO2++ H2O—e?= VO2++2H+(3分)
【解析】
试题分析:(1)①根据盖斯定律,2SO2(g)+O2(g)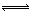 2SO3(g)的△H= -457kJ·mol-l—2×(-130kJ·mol-l)=—197 kJ·mol-l;使用催化剂,降低活化能,使反应速率加快。
2SO3(g)的△H= -457kJ·mol-l—2×(-130kJ·mol-l)=—197 kJ·mol-l;使用催化剂,降低活化能,使反应速率加快。
②Se元素由+4价降低为0,所以当有79gSe生成时,转移转移电子的物质的量为:79g÷79g/mol×4=4mol;根据氧化还原反应规律,SO2、SeO2、H2O反应生成H2SO4和Se,配平可得化学方程式:2SO2+SeO2+2H2O=2H2SO4+Se
(2)①根据电池结构图,正极上VO2+得电子生成VO2+,所以放电时的总反应方程式为:VO2++V2++2H+=VO2++V3++H2O;电极M为电池的正极,充电时应接电源的正极。
②第一步VO2+转化为V3+的电解方程式为:VO2++4H++2e?= V3++2H2O,消耗了H+,所以阴极区溶液n(H+)减小;阳极上VO2+失电子生成VO2+,所以电极方程式为:VO2++ H2O—e?= VO2++2H+。
考点:本题考查盖斯定律、催化剂、原电池和电解池原理、氧化还原反应方程式的书写及电子转移的计算。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2013-2014山东省潍坊市高三4月模拟考试理综化学试卷(解析版) 题型:简答题
(18分)钛被誉为“二十一世纪的金属”,用途广泛。按下图所示组成的产业链可以大大提高资源利用率并能减少环境污染。请回答下列问题:
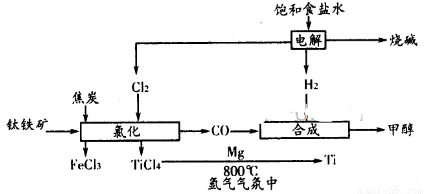
(1)已知中FeTiO3元素的化合价为+3,钛铁矿经氯化法得到四氯化钛的过程中________元素被氧化,每生产1. 9kgTiCl4 消耗Cl2在标准状况下的体积为________L。

则金属Mg还原TiCl4制取金属Ti (s)的热化学方程式为___________.
(3)某化学兴趣小组探究外界条件对合成甲醇反应的影响。
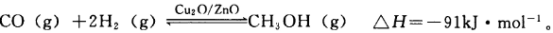
①在300℃时,向体积为1L的密闭容器中加入2mol H2和1mol CO,CO和CH3OH(g)的浓度随时间变化如图所示。
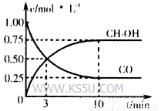
则从反应开始到建立平衡,v(H2)为___________ ;
该温度下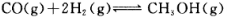 的化学平衡常
的化学平衡常
数为___________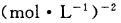 。
。
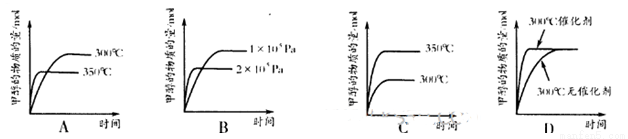
②在其它条件不变,只改变其中的一个条件,该小组同学
根据实验绘制如下图像,其中与事实相符的是为___________(填
序号)。
(4)电解饱和食盐水是氯碱工业的基础。
①电解饱和食盐水的离子方程式为为___________ 。
②电解时用盐酸控制阳极区溶液的pH在2~3,盐酸的作用为为___________。(用必要的离子方程式和文字说明)
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省潍坊市下学期期中考试高一化学试卷(解析版) 题型:选择题
如图所示是部分短周期元素化合价与原子序数的关系图,下列说法正确的是
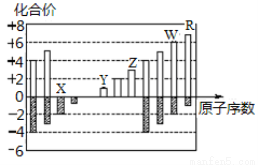
A.原子半径:Z>Y>X
B.气态氢化物的稳定性:R>W
C.WX3和水反应形成离子化合物
D.Y和Z两者最高价氧化物对应的水化物不能相互反应
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省淄博市高三第三次模拟考试理综化学试卷(解析版) 题型:选择题
结合如图装置判断,下列叙述正确的是
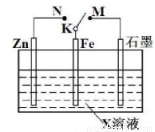
A.若X为NaCI,K与M相连时,石墨电极反应为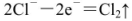
B.若X为硫酸,K与M相连时,Fe作负极受到保护
C.若X为硫酸,K与N相连时,溶液中H+向Fe电极移动
D.若X为NaCI,K与N相连时,溶液中加入少量K3[Fe(CN)6],有蓝色沉淀生成
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省淄博市高三二模理综化学试卷(解析版) 题型:推断题
(12分)【化学——有机化学基础】
克伦特罗是一种肾上腺类神经兴奋剂,其路线合成如图所示。
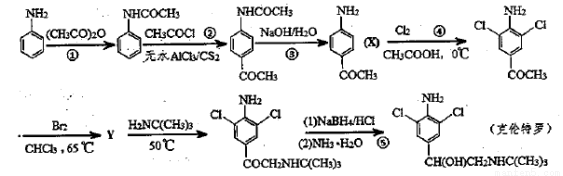
(1)克伦特罗的分子式为 。
(2)反应④、⑤的反应类型分别是 、 。
(3)反应③的化学反应方程式为 。
(4)Y的结构简式是 。
(5)含有苯环、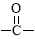 NH一且能发生银镜反应的X的同分异构体有 种。
NH一且能发生银镜反应的X的同分异构体有 种。
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省淄博市高三二模理综化学试卷(解析版) 题型:选择题
几种短周期元素的原子半径及主要化合价如下表,由此可知
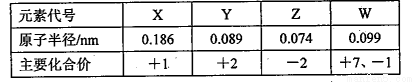
A.X、Y元素的金属性:X<Y
B.X、Z形成的化合物中一定不含共价键
C.W的最高价氧化物的水化物是一种强酸
D.离子半径:X+>Z2-
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省淄博市高一下学期期末考试化学试卷(解析版) 题型:填空题
(10分)有如图所示A~F六种仪器:
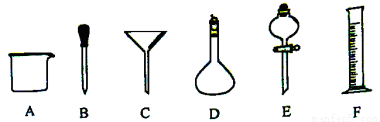
(1)写出仪器名称:D ,E ;
(2)请举例说出仪器A的用途(两种或两种以上) ;
(3)实验室配制一定物质的量浓度的盐酸,需用36.5%的浓盐酸4.5mL。取用4.5mL盐酸时,需要到上图仪器中的F和 (填编号);
(4)下列实验操作中用到仪器C的是 (选填下列选项的字母编号)。
a.分离水和CCl4的混合物
b.分离水和酒精的混合物
c.分离水和泥砂的混合物
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省济宁市3月质量检测高一化学试卷(解析版) 题型:填空题
(8分)含硫化合物的种类很多,现有H2SO4、H2SO3、SO2、Na2SO3、BaSO4、CuSO4、Na2SO4这7种常见的含硫化合物。回答下列问题:
(1)写出硫元素在周期表中位置______________
(2)Ba2+有剧毒。某市曾发生一起“毒烧饼”事件,起因是烧饼摊主在制作烧饼的过程中误将碳酸钡当作干粉使用,导致多人食用烧饼后中毒。试写出碳酸钡与胃酸(以盐酸表示)反应的离子反应方程式 。
(3)常温下,将铁棒置于浓硫酸中,无明显现象,课本上解释为发生了钝化,但有人认为未发生反应。为验证此过程,某同学经过思考,设计了如下实验:将经浓硫酸处理过的铁棒洗净后置于CuSO4溶液中,若铁棒表面 ,则发生了钝化。
(4)减少SO2的污染并变废为宝,我国正在探索在一定条件下用CO还原SO2得到单质硫的方法来除去SO2。该反应的化学方程式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com