
| 离子 | Cu2+ | Al3+ | NO3- | Cl- |
| 物质的量浓度(mol/L) | 1 | 1 | a | 1 |
| A. | 阳极生成1.5mol Cl2 | B. | a=3 | ||
| C. | 电解后溶液中c(H+)=1moL/L | D. | 阴极析出的金属是铜与铝 |
分析 由溶液电荷守恒可知2c(Cu2+)+3c(Al3+)=c(NO3-)+c(Cl-),可求得c(NO3-)=4moL/L,
由于离子放电顺序Cu2+>H+>Al3+,Cl->OH->NO3-,电解时阳极首先发生:2Cl--2e-=Cl2↑,1mol氯离子放电转移1mol电子,然后发生4OH--4e-=O2↑+2H2O,阴极首先发生:Cu2++2e-=Cu,1molCu2+反应转移2mol电子,然后发生2H++2e-=H2↑,最后溶液中溶质为Al(NO3)、HNO3,根据电荷守恒计算溶液中c(H+),再根据pH=-lgc(H+)计算溶液pH值.
解答 解:由溶液电荷守恒可知2c(Cu2+)+3c(Al3+)=c(NO3-)+c(Cl-),则:2×1mol/L+3×1mol/L=+)=c(NO3-)+1mol/L,可求得c(NO3-)=4moL/L,
溶液中n(u2+)=n(Al3+)=n(Cl-)=1L×1mol/L=1mol,
离子放电顺序Cu2+>H+>Al3+,Cl->OH->NO3-,电解时阳极首先发生:2Cl--2e-=Cl2↑,1mol氯离子放电转移1mol电子,生成0.5mol氯气,然后发生4OH--4e-=O2↑+2H2O,生成氧气为$\frac{3mol-1mol}{4}$=0.5mol;
阴极首先发生:Cu2++2e-=Cu,1molCu2+反应转移2mol电子,然后发生2H++2e-=H2↑,最后溶液中溶质为Al(NO3)、HNO3.
A.阳极生成0.5mol氯气、0.5mol氧气,故A错误;
B.由上述分析可知:a=4,故B错误;
C.根据电荷守恒,溶液中c(H+)+3c(Al3+)=c(NO3-),即c(H+)+3×1mol/L=4mol/L,故c(H+)=1mol/L,故C正确;
D.离子放电顺序Cu2+>H+>Al3+,没有Al生成,阴极析出的金属是铜,故D错误,
故选:C.
点评 本题考查电解原理及计算,侧重考查学生分析计算能力,关键是掌握离子放电顺序,A中注意利用守恒法计算氢离子浓度,避免利用电极反应式的繁琐,难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ① | ② | ③ | ④ |
| 0.1mol/L 盐酸 | pH=3 盐酸 | 0.1mol/L 氨水 | pH=11 氨水 |
| A. | 由水电离出的c(H+):①>③ | |
| B. | ③稀释到原来的100倍后,pH与④相同 | |
| C. | ①与③混合,若溶液pH=7,则V(盐酸)>V(氨水) | |
| D. | ②与④混合,若溶液显碱性,则所得溶液中离子浓度可能为:c(NH4+)>c(OH-)>c(Cl-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 青铜的熔点比纯铜和锡都高 | B. | 陶瓷的主要成分为硅酸盐 | ||
| C. | 古代的纸张主要成分为蛋白质 | D. | 黑火药爆炸时,氧化剂只有硝酸钾 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
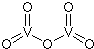 铬、钒、镨(Pr)、铈(Ce)等金属在工农业生产中有广泛的应用.
铬、钒、镨(Pr)、铈(Ce)等金属在工农业生产中有广泛的应用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KNO3 | B. | K2CO3 | C. | HNO3 | D. | Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定有甲烷 | B. | 一定有乙烯 | C. | 一定有乙炔 | D. | 一定有乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4种溶液pH的大小顺序:①>④>③>② | |
| B. | ①、②混合后pH>7,则混合溶液中c(NH4+)<c(NH3•H2O) | |
| C. | ①、②中分别加入25mL0.1mol•L-1盐酸后,溶液中c(NH4+):①>② | |
| D. | ③、④中分别加入12.5mL0.1mol•L-1NaOH溶液后,两溶液中离子种类相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com