
某课外兴趣小组为探究某种铝合金(合金元素为Mg 和Al)是否符合国家质量标准(国家规定其中铝含量不能低于78%),设计下图装置进行实验。
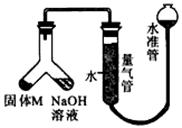
(1)如何检验该装置的气密性 。
(2)合金样品固体M与氢氧化钠溶液反应的离子方程式 。
(3)反应前先第一次读取量气管液面刻度,然后倾斜左边装置使氢氧化钠溶液(足量)与a g合金粉末(固体M)充分反应,待反应停止后,气体温度恢复到室温,想要第二次读取量气管液面刻度前需要进行的一步操作是 。通过读取液面差,并将气体体积折算成标准状况下体积为V mL。若量气管最大量程为50 mL,则固体M中铝的质量(mA1)范围为 。
(4)若a=38 mg,V=44.8 mL(标准状况),请通过计算说明该合金是否符合国家标准 (填“符合”或“不符合”)。
(5)若将装置中的氢氧化钠溶液替换为足量的盐酸,则反应停止后量气管内气体体积 (填“>”“<”“=”)V mL。
科目:高中化学 来源: 题型:
下列性质的比较中,正确的是
A.氧化性:S > Cl2 B.金属性:K<Na
C. 热稳定性:NaHCO3>Na2CO3 D. 酸性:HClO4>H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
由Na2CO3·nH2O与NaHCO3组成的混合物28.2 g,放入坩埚中充分加热至质量不变时,将残留固体用足量的盐酸溶解可产生标准状况下的气体3.36 L;若将28.2 g原混合物与盐酸反应,则放出标准状况下气体4.48 L,由此计算。
(1)残留固体质量;
(2)n值;
(3)NaHCO3质量。(写出计算求解的过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验中,所采取的分离方法与对应原理都正确的是( )
| 选项 | 目的 | 分离方法 | 原理 |
| A. | CO2中混有的少量CO | 通入适量O2点燃 | CO会燃烧成CO2 |
| B. | 除去鸡蛋清胶体中混有的NaCl | 过滤 | 鸡蛋清胶体不能通过滤纸 |
| C. | 除去NaHCO3固体中混有的Na2CO3 | 加热 | NaHCO3受热分解 |
| D. | 除去BaSO4粉末中混有的BaCO3 | 盐酸溶解后过滤、洗涤 | 盐酸可溶解BaCO3,不溶解BaSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液可能含有Cl-、SO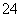 、CO
、CO 、NH
、NH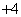 、Cu2+、Al3+和K+。取该溶液100 mL,加入过量NaOH溶液,加热,得到0.02 mol气体,同时产生蓝色沉淀;过滤,洗涤,低温烘干,得到2.94 g固体;向上述滤液中加足量BaCl2溶液,得到4.66 g不溶于盐酸的沉淀。由此可知原溶液中( )
、Cu2+、Al3+和K+。取该溶液100 mL,加入过量NaOH溶液,加热,得到0.02 mol气体,同时产生蓝色沉淀;过滤,洗涤,低温烘干,得到2.94 g固体;向上述滤液中加足量BaCl2溶液,得到4.66 g不溶于盐酸的沉淀。由此可知原溶液中( )
A.至少存在5种离子
B.Cl-一定存在,且c(Cl‑)≥0.4 mol/L
C.SO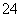 、NH
、NH 一定存在,Cl-可能不存在
一定存在,Cl-可能不存在
D.CO 、Al3+一定不存在,K+可能存在
、Al3+一定不存在,K+可能存在
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如图所示。下列判断正确的是( )
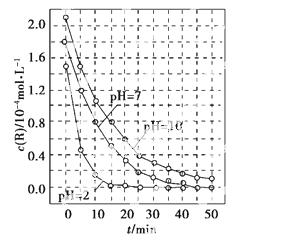
A.在0~50 min之间,pH=2和pH=7时R的降解百分率相等
B.溶液酸性越强,R的降解速率越小
C.R的起始浓度越小,降解速率越大
D.在20~25 min之间,pH=10时R的平均降解速率为0.04 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,依据I2析出所需时间可以求得NaHSO3的反应速率。将浓度均为0.020 mol·L-1的NaHSO3溶液(含少量淀粉)10.0 mL、KIO3(过量)酸性溶液40.0 mL混合,记录10~55 ℃间溶液变蓝时间,55 ℃时未观察到溶液变蓝,实验结果如图所示。据图分析,下列判断不正确的是( )
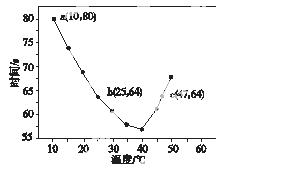
A.40 ℃之前与40 ℃之后溶液变蓝的时间随温度的变化趋势相反
B.图中b、c两点对应的NaHSO3反应速率相等
C.图中a点对应的NaHSO3反应速率为5.0×10-5 mol·L-1·s-1
D.温度高于40 ℃时,淀粉不宜用作该实 验的指示剂
验的指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
根据酸碱的质子理论,“凡是能给出质子的分子或离子都是酸;凡是能结合质子的分子或离子都是碱。”按这个理论,下列微粒:
①HS-,②CO32-,③HPO42-,④NH3,⑤OH-,⑥H2O,⑦HCO3-,⑧HAc,⑨KHSO4
(1)只属于碱的微粒是: ;
(2)只属于酸的微粒是: ;
(3)属于两性的微粒是: 。(填编号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A、B、C、D、E、F是含有同一种元素的化合物,其中F是能使湿润红色石蕊试纸变蓝的气体,它们之间能发生如下反应:①A+H2O→B+C ②C+F→D ③D+NaOH F+E+H2O
F+E+H2O
(1)写出它们的化学式:A 、B 、C 、D 、E 、F ;
(2)写出各步反应的化学方程式,并指出反应①的氧化剂和还原剂.
① ,氧化剂 、还原剂 .
② .
③ .
(3)工业生产C的过程中有如下一步反应,即F经催化氧化生成B和H2O,写出该步反应的化学方程式 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com