
 .
. Al(OH)3+3H+(用离子方程式表示).
Al(OH)3+3H+(用离子方程式表示).| X | ||||
| Y | Z | W |
分析 Y所处的周期序数与族序数相等,短周期元素,则Y为第三周期第ⅢA族元素,即Y为Al,由元素的位置可知,Z为Si,X为N,W为Cl,以此来解答.
解答 解:Y所处的周期序数与族序数相等,短周期元素,则Y为第三周期第ⅢA族元素,即Y为Al,由元素的位置可知,Z为Si,X为N,W为Cl,
(1)X为N元素,核外有2个电子层,最外层电子数为5,原子结构示意图为 ,故答案为:
,故答案为: ;
;
(2)比较非金属性,可根据氢化物的稳定性如HCl>SiH4,或最高价氧化物对应的酸性的强弱,如HClO4>H2SiO3或2HClO4+Na2SiO3═2NaClO4+H2SiO3↓,或与氢气反应的难易程度,
故答案为:氯比硅更容易与氢气化合(或气态氢化物稳定性:HCl>SiH4或酸性:HClO4>H2SiO3或2HClO4+Na2SiO3═2NaClO4+H2SiO3↓);
(3)Y为Al,铝离子以水解生成氢氧化铝胶体,具有吸附性,可用于净水,离子方程式为Al3++3H2O Al(OH)3+3H+,
Al(OH)3+3H+,
故答案为:Al3++3H2O Al(OH)3+3H+.
Al(OH)3+3H+.
点评 本题考查位置、结构、性质的应用,为高频考点,把握短周期元素的位置及Y的周期序数与族序数相等为解答的关键,侧重分析推断能力的考查,题目难度不大.


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:选择题
| A. | 因为反应物浓度越大,反应速率越快,所以常温下,相同的铝片中分别加入足量的浓、稀硝酸,浓硝酸中铝片先溶解完 | |
| B. | 增大反应物浓度可加快反应速度,因此用浓硫酸与铁反应能增大生成H2的速率 | |
| C. | 对化学反应速率起决定性作用的因素是参加反应的各物质的性质 | |
| D. | 化学反应速率也可以用单位时间内固体物质的消耗量或者气体物质的生成量来表示 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
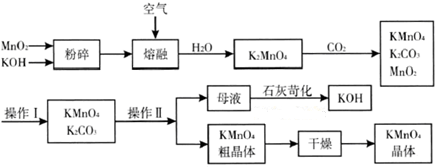
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 有MgCl2、Al2(SO4)3的混合溶液,向其中不断加入NaOH溶液,得到的沉淀量与加入的NaOH溶液的关系如图所示,则溶液中Cl-与SO42-之比为( )
有MgCl2、Al2(SO4)3的混合溶液,向其中不断加入NaOH溶液,得到的沉淀量与加入的NaOH溶液的关系如图所示,则溶液中Cl-与SO42-之比为( )| A. | 2:3 | B. | 1:3 | C. | 3:2 | D. | 2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
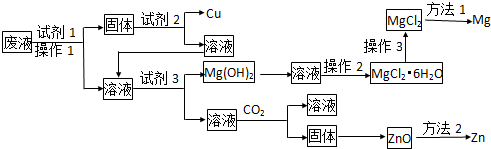
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
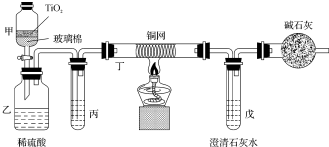
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 水杨酸甲酯又叫冬青油,是一种重要的有机合成原料.某化学小组用水杨酸(
水杨酸甲酯又叫冬青油,是一种重要的有机合成原料.某化学小组用水杨酸( )和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率.
)和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率.| 名称 | 分子量 | 颜色状态 | 相对密度 | 熔点(℃) | 沸点(℃) |
| 水杨酸甲酯 | 152 | 无色液体 | 1.18 | -8.6 | 224 |
| 水杨酸 | 138 | 白色晶体 | 1.44 | 158 | 210 |
| 甲醇 | 32 | 无色液体 | 0.792 | -97 | 64.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤⑥ | B. | ②③⑥ | C. | ②④⑤⑥ | D. | 只有④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 可简化为:
可简化为: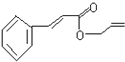 杀虫剂“阿乐丹”的结构表示为:
杀虫剂“阿乐丹”的结构表示为: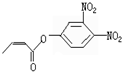 ,它在稀酸作用下能发生水解反应生成两种有机物.下列关于这两种有机物的共同性质叙述不正确的是( )
,它在稀酸作用下能发生水解反应生成两种有机物.下列关于这两种有机物的共同性质叙述不正确的是( )| A. | 遇FeCl3溶液均显紫色 | B. | 均能发生氧化反应 | ||
| C. | 均能与溴水发生反应 | D. | 均能与NaOH溶液发生反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com