

(1)连接上述装置的正确顺序是(填各接口的字母):I接________,________接________,________接________,________接________,F接________。
(2)使用③号装置的作用是,④号装置的作用是________________________________。
(3)检验⑥号装置中收集的气体的方法是________________,现象是________________。
(4)若反应前称量直玻璃管的质量为100 g,直玻璃管与固体样品总质量为110 g,反应后称量直玻璃管和固体总质量为112.8 g,则样品中Na2O2的质量分数为________。
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案科目:高中化学 来源: 题型:阅读理解

| 实验步骤 | 预期现象和结论 |
| 步骤1:取B中的少量固体样品于试管中,滴加足量蒸馏水,溶解,然后取少量待测液分别置于Ⅰ、Ⅱ试管中. | 固体完全溶解 |
| 步骤2:往Ⅰ试管中加入 足量的1 mol?L-1盐酸 足量的1 mol?L-1盐酸 ,再滴加1 mol?L-1 BaCl2溶液 1 mol?L-1 BaCl2溶液 . |
有白色沉淀生成 有白色沉淀生成 ,则证明生成物中含Na2SO4. |
| 步骤3:往Ⅱ试管中 2~3滴0.01mol?L-1KMnO4酸性溶液,振荡 2~3滴0.01mol?L-1KMnO4酸性溶液,振荡 删除此空 删除此空 . |
若 KMnO4溶液紫红色褪去 KMnO4溶液紫红色褪去 ,则说明生成物中有Na2SO3;若 KMnO4溶液紫红色不褪去 KMnO4溶液紫红色不褪去 删除此空 删除此空 ,则说明生成物中没有Na2SO3. |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东省湛江市普通高考测试(二)理综化学试卷(解析版) 题型:实验题
为了探究SO2与Na2O2的反应是否类似于CO2,甲同学设计了如图实验装置。回答下列问题:

(1)移开棉花,将带火星的木条放在C试管口,未见木条复燃。甲同学因此认为SO2与Na2O2的反应不同于CO2。请按甲同学的观点写出反应的化学方程式 。
(2)乙同学认为无论反应原理如何,最终都有O2产生。乙同学的理由是 。
按照乙同学的观点,该装置需作的改进是: 。
(3)假设Na2O2 完全反应,反应后B装置中固体生成物可能是:
① Na2SO3; ② Na2SO4; ③ Na2SO3和Na2SO4
请设计实验方案检验,写出实验步骤以及预期现象和结论,完成下表:
限选试剂:2 mol·L-1 HCl, 1mol·L-1HNO3, 1 mol·L-1 BaCl2, 1 mol·L-1 Ba(NO3)2,
0.01mol·L-1KMnO4酸性溶液。
|
实验步骤 |
预期现象和结论 |
|
步骤1:取B中的少量固体样品于试管中,滴加足量蒸馏水,溶解,然后取少量待测液分别置于Ⅰ、Ⅱ试管中。 |
固体完全溶解 |
|
步骤2:往Ⅰ试管中加入 ,再滴加 。 |
,则证明生成 物中含Na2SO4。 |
|
步骤3:往Ⅱ试管中 。 |
若 , 则说明生成物中有Na2SO3;若 , 则说明生成物中没有Na2SO3。 |
(4)生成物中亚硫酸钠含量的测定:①取a克生成物配制成100ml溶液,取10.00mL该溶液于锥形瓶中,加入几滴淀粉溶液作指示剂,用0.0100mol·L-1碘水进行滴定,滴定终点现象为 ,记录数据,重复滴定2次,平均消耗碘水20.00mL。
②计算:生成物中亚硫酸钠的质量分数为 。(Na2SO3的式量为126)
查看答案和解析>>
科目:高中化学 来源:模拟题 题型:实验题


查看答案和解析>>
科目:高中化学 来源: 题型:
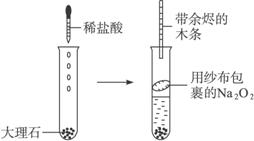
操作步骤如下:①在试管中放入几块大理石,滴入2—3 mL稀盐酸
②用燃着的火柴检验CO2的生成
③用镊子将用纱布包好的Na2O2塞入试管中部
④用带余烬的木条检验O2的生成请完成下列问题:
(1)为什么在包有Na2O2的纱布塞入之前,先用火柴检验?
(2)实验④的现象怎样?
(3)如果实验第④步未观察到应有现象,其可能的原因是什么?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com