
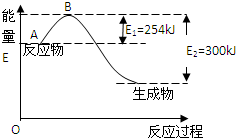
 氮元素在地球上丰度较大,氮及其化合物用途广泛.请回答:
氮元素在地球上丰度较大,氮及其化合物用途广泛.请回答:| 化学键 | H-H | N≡N |
| 键能/( kJ/mol) | 435 | 943 |
分析 (1)先求出此反应的焓变,根据热化学方程式的书写规则再写出热化学方程式;
(2)根据反应热等于反应物的总键能减去生成物的总键能计算;
(3)已知①4NH3(g)+3O2(g)=2N2(g)+6H2O(g);△H1=-akJ/mol
②N2(g)+O2(g)=2NO(g);△H2=-bkJ/mol
利用盖斯定律将①-②×3可得:4NH3(g)+6NO(g)═5N2(g)+6H2O(g),根据化合价的变化确定反应物和产物.
解答 解:(1)反应物总能量大于生成物总能量,应为放热反应,生成1mol氨气放出46kJ热量,则反应的热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-92kJ/mol,
故答案为:N2(g)+3H2(g)?2NH3(g)△H=-92kJ/mol;
(2)反应热等于反应物的总键能减去生成物的总键能,设N-H的键能为x,
则943KJ/mol+3×435KJ/mol-6x=-92KJ/mol,x=390KJ/mol,故答案为:390;
(3)已知①4NH3(g)+3O2(g)=2N2(g)+6H2O(g);△H1=-akJ/mol
②N2(g)+O2(g)=2NO(g);△H2=-bkJ/mol
利用盖斯定律将①-②×3可得:4NH3(g)+6NO(g)═5N2(g)+6H2O(g),△H=-(a+3b)kJ/mol,化合价降低的N元素所在的反应物NO是氧化剂,化合价升高的N元素所在的反应物NH3是还原剂,故答案为:-(a+3b);NO;NH3.
点评 本题考查综合考查化学反应与能量变化知识,注意物质的总能量、键能与反应热的计算关系,把握盖斯定律的计算方法,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 不能形成稳定的气态氢化物 | B. | 其原子最外层有6个电子 | ||
| C. | 其最高价氧化物的水化物是强酸 | D. | X是金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸与甲醇在浓硫酸作用下共热 | B. | 用丙烯与氯化氢反应制氯丙烷 | ||
| C. | 乙醛与银氨溶液共热 | D. | 溴乙烷与NaOH的醇溶液共热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
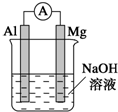 将镁条、铝条平行插入一定浓度的NaOH溶液中,用导线和电流表连接成原电池.装置如图所示,此电池工作时,下列叙述中正确的是( )
将镁条、铝条平行插入一定浓度的NaOH溶液中,用导线和电流表连接成原电池.装置如图所示,此电池工作时,下列叙述中正确的是( )| A. | Mg比Al活泼,Mg失去电子被氧化成Mg2+ | |
| B. | 铝条表面虽有氧化膜,但可不必处理 | |
| C. | 正极反应式为2H++2e-═H2↑ | |
| D. | Al是电池负极,开始工作时溶液中会立即有白色沉淀析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验编号 | C(HA)mol•L-1 | c(MOH)/mol•L-1 | 混合溶液的pH |
| 甲 | pH=2 | pH=12 | pH<7 |
| 乙 | 0.1 | 0.1 | pH=a |
| 丙 | c1 | 0.2 | pH=7 |
| 丁 | 0.2 | 0.1 | pH<7 |
| A. | a>7 | |
| B. | 在乙组混合液中c(OH-)-c(HA)=10-amol/L | |
| C. | c1<0.2 | |
| D. | 在丁组混合液中c(M+)>c(A-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子质量 | B. | 质量 | C. | 密度 | D. | 原子总数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com