
【题目】Ⅰ、物质变化观念是化学学科核心素养之一。已知a、b、c、d、e五种物质的相互转化关系如图所示,其中a、d、e为常见的单质,b、c为化合物。
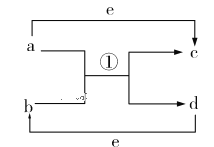
(1)若a、d为短周期非金属单质,且a、d所含元素同主族,a、e所含元素在不同周期。则b、c的沸点:b_________c(填“<”“>”或“=”);a和b反应生成两种氧化物的化学方程式为_________________。
(2)若a是常见的金属单质,点燃发出耀眼白光。d为固态非金属单质,熔点很高,其某种形态单质硬度极大,e为常见的气体单质,则a和b反应的化学方程式为________________________________。
(3)若a、d为常见的金属单质,它们与浓硝酸在加热条件下才能顺利反应。a既可以与强酸反应也可以与强碱反应,d在e中燃烧可以生成b。则足量的d与稀硝酸反应的离子方程式为__________________________________________。
Ⅱ、HNO2是一种弱酸,且不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+。AgNO2是一种难溶于水、易溶于酸的化合物。试回答下列问题:
(4)人体正常的血红蛋白含有Fe2+。若误食亚硝酸盐(如NaNO2)则导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒。下列叙述不正确的是________(填字母)。
A.亚硝酸盐被还原 B.维生素C是还原剂
C.维生素C将Fe3+还原为Fe2+ D.亚硝酸盐是还原剂
(5)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式:________________________________________________。
【答案】< 2H2S +3O2![]() 2SO2 +2H2O 2Mg+CO2
2SO2 +2H2O 2Mg+CO2![]() 2MgO+C 3Fe+8H++2
2MgO+C 3Fe+8H++2![]()
![]() 3Fe2++2NO↑ +4H2O D NO
3Fe2++2NO↑ +4H2O D NO![]() +Cl2+H2O===NO3-+2H++2Cl-
+Cl2+H2O===NO3-+2H++2Cl-
【解析】
Ⅰ、(1)若a、d为短周期非金属单质,且a、d所含元素同主族,则a为O2、d为S;a、e所含元素在不同周期,则e为H2。H2S分子间不能形成氢键,而H2O分子间可形成氢键,从而得沸点关系出b<c;O2和H2S反应生成H2O和SO2。
(2)若a是常见的金属单质,点燃发出耀眼白光,则其为镁。d为固态非金属单质,熔点很高,其某种形态单质硬度极大,则其为碳,则b为CO2,c为MgO,从而得出e为O2,由此可得出a和b反应的化学方程式。
(3)若a、d为常见的金属单质,它们与浓硝酸在加热条件下才能顺利反应,言外之意是在常温下反应不能顺利进行,则a为Al,d为Fe。Fe在O2中燃烧可以生成Fe3O4。足量的Fe与稀硝酸反应,生成Fe(NO3)2、NO和H2O。
Ⅱ、(4)A.亚硝酸盐能将Fe2+转化为Fe3+,则其作氧化剂,被还原,A正确;
B.维生素C能将Fe3+转化为Fe2+,则其为还原剂,B正确;
C.维生素C作为还原剂,能将Fe3+还原为Fe2+,C正确;
D.亚硝酸盐将Fe2+转化为Fe3+,则其是氧化剂,D错误。
(5)新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,依题意可写出反应的离子方程式。
Ⅰ、(1)若a、d为短周期非金属单质,且a、d所含元素同主族,则a为O2、d为S;a、e所含元素在不同周期,则e为H2。H2S分子间不能形成氢键,而H2O分子间可形成氢键,从而得出b、c的沸点关系为b<c;O2和H2S反应化学方程式为2H2S +3O2![]() 2SO2 +2H2O。答案为:<;2H2S +3O2
2SO2 +2H2O。答案为:<;2H2S +3O2![]() 2SO2 +2H2O;
2SO2 +2H2O;
(2)若a是常见的金属单质,点燃发出耀眼白光,则其为镁。d为固态非金属单质,熔点很高,其某种形态单质硬度极大,其为碳,则b为CO2,c为MgO,从而得出e为O2,由此可得出a和b反应的化学方程式为2Mg+CO2![]() 2MgO+C。答案为:2Mg+CO2
2MgO+C。答案为:2Mg+CO2![]() 2MgO+C;
2MgO+C;
(3)若a、d为常见的金属单质,它们与浓硝酸在加热条件下才能顺利反应,言外之意是在常温下反应不能顺利进行,则a为Al,d为Fe。Fe在O2中燃烧可以生成Fe3O4。足量的Fe与稀硝酸反应的离子方程式为3Fe+8H++2![]() =3Fe2++2NO↑ +4H2O。答案为:3Fe+8H++2
=3Fe2++2NO↑ +4H2O。答案为:3Fe+8H++2![]() =3Fe2++2NO↑ +4H2O;
=3Fe2++2NO↑ +4H2O;
Ⅱ、(4)A.亚硝酸盐能将Fe2+转化为Fe3+,则其作氧化剂,被还原,A正确;
B.维生素C能将Fe3+转化为Fe2+,则其为还原剂,B正确;
C.维生素C作为还原剂,能将Fe3+还原为Fe2+,C正确;
D.亚硝酸盐将Fe2+转化为Fe3+,则其是氧化剂,D错误。答案为:D;
(5)新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,依题意可得反应的离子方程式为NO![]() +Cl2+H2O==NO3-+2H++2Cl-。答案为:NO
+Cl2+H2O==NO3-+2H++2Cl-。答案为:NO![]() +Cl2+H2O==NO3-+2H++2Cl-。
+Cl2+H2O==NO3-+2H++2Cl-。


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D都是短周期元素,其原子序数依次增大。A的族系数等于周期数的3倍,B元素原子的最外层只有1个电子,该元素阳离子与Ne核外电子排布相同;C元素原子的外围电子排布为ns2np1;D与A同族。
(1)写出A、C、D的元素符号:A__,C__,D__。
(2)B元素原子的电子排布图为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一份澄清溶液, 可能含有 Na+、 K+、 NH4+、 Ca2+、 Fe3+、 SO42-、 CO32-、 SO32-、 Cl-、I-中的若干种, 且离子的物质的量浓度均为 0.1 mol·L-1(不考虑水解和水的电离)。 往该溶液中加入过量的盐酸酸化的 BaCl2 溶液, 无沉淀生成。 另取少量原溶液, 设计并完成如下实验:
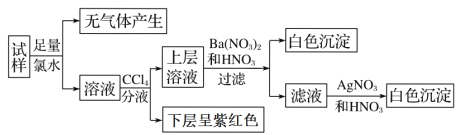
则关于原溶液的判断中不正确的是
A. 是否存在 Na+、K+需要通过焰色反应来确定
B. 通过CCl4 层的颜色变化,也能判断出原溶液中是否存在Fe3+
C. 虽然实验过程引入了氯元素, 但不影响原溶液是否存在Cl-的判断
D. 肯定不存在的离子是 Ca2+、Fe3+、SO42-、CO32-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用示意图或图示的方法能够直观形象地将化学知识传授给学生,下列示意图或图示正确的是( )
A.砷原子的结构示意图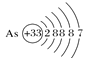 B.BF4—的结构式
B.BF4—的结构式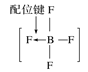
C.HF分子间的氢键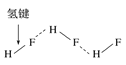 D.丙氨酸的手性异构
D.丙氨酸的手性异构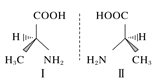
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可以证明可逆反应N2 + 3H22NH3已达到平衡状态的是( )
①一个N≡N断裂的同时,有3个H-H键断裂
②一个N≡N键断裂的同时,有6个N-H键断裂
③其它条件不变时,混合气体平均式量不再改变
④保持其它条件不变时,体系压强不再改变
⑤NH3%、N2%、H2%都不再改变
⑥恒温恒容时,密度保持不变
⑦正反应速率v(H2)=0.6mol/(L·min),逆反应速率v(NH3)=0.4mol/(L·min)
A.全部B.只有③④⑤C.②③④⑤⑦D.只有③⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌灰是炼锌厂的烟道灰,含ZnO 35%以上,还含有少量的氧化锰(MnO)、氧化铜、 铁的氧化物和不溶于酸的杂质,工业上常用酸浸法回收 ZnSO4·7H2O。已知 ZnSO4·7H2O 晶体易溶于水,难溶于酒精,某兴趣小组实验室模拟回收 ZnSO4·7H2O 晶体,流程如下:

请回答:
(1)分析步骤 II 中的操作和原理, 回答下列问题:
①结合表 1、 2,分析选择的 pH 及温度分别是______________________, 其中, 可以采用加入_________________________来调节 pH ;
表1 pH对ZnSO4.7H2O 回收量及纯度的影响
pH | ZnSO4.7H2O 回收量(g) | 产品中Fe的含量% | 产品中其他重金属含量% |
1 | 114.32 | 0.750 | 0.059 |
2 | 114.4 | 0.086 | 0.056 |
3 | 113.68 | 0.034 | 0.054 |
4 | 113.60 | 0.010 | 0.050 |
5 | 112.43 | 0.010 | 0.050 |
表2 温度对ZnSO4.7H2O 回收量及纯度的影响
温度 (℃) | ZnSO4.7H2O 回收量(g) | 产品中F的含量% | 产品中其他重金属含量% |
20 | 111.45 | 0.011 | 0.052 |
40 | 112.89 | 0.010 | 0.051 |
60 | 113.30 | 0.010 | 0.050 |
80 | 113.80 | 0.010 | 0.050 |
90 | 114.40 | 0.091 | 0.048 |
②酸性 KMnO4 溶液将溶液中的 Fe2+氧化,生成两种沉淀;同时,过量的高锰酸钾在微酸性的条件能自动分解生成MnO2 沉淀。试写出在该环境下,KMnO4 溶液氧化 Fe2+的离子反应方程式_________________________________________。 若用稀硝酸做氧化剂,除了产物中可能含有 Zn(NO3)2 外,还可能的缺点是:_________________________;
(2)分析整个实验过程中,回答下列问题:
①滤渣 B 的主要成分为___________________________;
②如何检验滤液B中是否含有铁元素_____________________________________;
③写出生成滤渣C的离子方程式__________________________________________;
(3)为测定 ZnSO4·7H2O 晶体的纯度,可用 K4Fe(CN)6 标准液进行滴定。主要原理如下:2K4Fe(CN)6+ 3ZnSO4= K2Zn3[Fe(CN)6]2↓+ 3K2SO4
准确称取 5.000g ZnSO4·7H2O 晶体,用蒸馏水溶解并定容至 250mL,准确移取该溶液 25.00mL至锥形瓶中,用 0.0500mol/L K4Fe(CN)6 溶液进行滴定,所得数据如下表:
实验次数 | 滴定前读数/mL | 滴定后读数/mL |
1 | 0.10 | 19.92 |
2 | 1.34 | 21.12 |
3 | 0.00 | 20.10 |
则 ZnSO4·7H2O 晶体的纯度是_______________(以质量分数表示,保留到小数点后两位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将3 mol A气体和1 mol B气体通入一容积固定为2 L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g),请填写下列空白:
xC(g),请填写下列空白:
(1)反应1 min时测得剩余1.8 mol A,C的浓度为0.4 mol/L,则1 min内,B的平均反应速率为___________;x为____________。
(2)若反应经2 min达到平衡,平衡时C的浓度______________0.8 mol/L(填“大于”、“小于”或“等于”)
(3)能加快反应速率的措施是____________。
①升高温度
②容器体积不变,充入惰性气体Ar
③容器压强不变,充入惰性气体Ar
④使用催化剂
⑤将容器体积缩小一半
(4)能够说明该反应达到平衡的标志是____________。
A.容器内混合气体的密度保持不变
B.容器内混合气体的压强保持不变
C.A、B的浓度之比为3:1
D.单位时间内断开3n mol A-A键的同时生成n mol B-B
E.v(A)=3v(B)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用甲醇和水蒸气重整为燃料电池提供氢气。甲醇和水蒸气重整的主要反应是:反应i:CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g) △H1= +49 kJ/mol。同时,存在副反应:反应ii:CH3OH(g)
CO2(g)+3H2(g) △H1= +49 kJ/mol。同时,存在副反应:反应ii:CH3OH(g)![]() CO(g)+2H2(g) △H2= +91 kJ/mol
CO(g)+2H2(g) △H2= +91 kJ/mol
(1)反应i的平衡常数K的表达式是_______。
(2)为探究条件对反应i平衡的影响,X、 Y(Y1、Y2)可分别代表压强或温度。下图表示Y一定时,反应i中H2O(g)的平衡转化率随X的变化关系。

① X代表的物理量是_______。
② 判断Y1_______Y2(填“>”或“<”),理由是_______。
(3)CO易使反应i的催化剂中毒,研究温度和投料比对甲醇转化率及重整气中CO物质的量分数的影响,结果如图所示。

①选择250℃、水/甲醇投料比为2作为最佳条件进行反应,原因是_______。
②250℃时CO物质的量分数始终高于200℃时CO物质的量分数的原因可能是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com