

 .
.分析 根据咖啡酸环上有三个取代基可知奎尼酸的结构为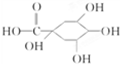 ,咖啡酸A的结构为
,咖啡酸A的结构为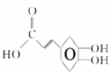 ;咖啡酸A分子中含有碳碳双键,故与Br2/CC14溶液反应为加成反应;咖啡酸
;咖啡酸A分子中含有碳碳双键,故与Br2/CC14溶液反应为加成反应;咖啡酸 含有羧基和酚羟基,酚羟基和碳酸氢钠不反应,故A
含有羧基和酚羟基,酚羟基和碳酸氢钠不反应,故A 与碳酸氢钠反应生成的B为
与碳酸氢钠反应生成的B为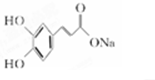 ;B中含有酚羟基能与与氢氧化钠反应,生成的C为
;B中含有酚羟基能与与氢氧化钠反应,生成的C为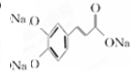 ,化学式为C9H5O4Na3,据此然后结合有机物的结构与性质来解答.
,化学式为C9H5O4Na3,据此然后结合有机物的结构与性质来解答.
解答 解:咖啡酸环上有三个取代基可知奎尼酸的结构为 ,咖啡酸A的结构为
,咖啡酸A的结构为 ;咖啡酸A分子中含有碳碳双键,故与Br2/CC14溶液反应为加成反应;咖啡酸
;咖啡酸A分子中含有碳碳双键,故与Br2/CC14溶液反应为加成反应;咖啡酸 含有羧基和酚羟基,酚羟基和碳酸氢钠不反应,故A
含有羧基和酚羟基,酚羟基和碳酸氢钠不反应,故A 与碳酸氢钠反应生成的B为
与碳酸氢钠反应生成的B为 ;B中含有酚羟基能与与氢氧化钠反应,生成的C为
;B中含有酚羟基能与与氢氧化钠反应,生成的C为 ,
,
(1)A.1mol绿原酸水解产物中含有2mol羧基和2魔力酚羟基,则1mol绿原酸最多可以和4molNaOH反应,故A错误;
B.绿原酸中含有醇羟基,且与羟基相邻碳上含有H,所以一定条件下可发生消去反应,故B正确;
C.绿原酸中含有1个碳碳双键和1个苯环,则1mol绿原酸最多可以和4molH2反应,故C错误;
D.绿原酸分子中含有醇羟基,在一定条件下可与乙酸发生酯化代反应,故D正确;
故答案为:BD;
(2)绿原酸为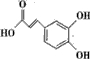 ,含有官能团为:-OH、-COOH、C=C,含氧官能团名称为:酚羟基、羧基;
,含有官能团为:-OH、-COOH、C=C,含氧官能团名称为:酚羟基、羧基;
奎尼酸为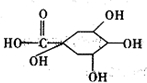 ,其分子式为:C7H12O6,
,其分子式为:C7H12O6,
故答案为:酚羟基、羧基;C7H12O6;
(3)反应①为A中碳碳双键与溴水的加成反应,
故答案为:加成反应;
(4)B中含2个酚-OH与NaOH反应,则1molB需要消耗2molNaOH,
故答案为:2mol;
(5)A生成B的化学方程式为 ,
,
故答案为: ;
;
(6)符合①遇FeCl3溶液显色,含酚-OH;②1mol E能消耗2mol Na或1mol NaOH,还含1个-OH;③1 mol E与足量新制Cu(OH)2反应生成2mol Cu2O,含2个-CHO;④苯环上只有一种化学环境的H,苯环上只有1种H,则符合条件的同分异构体为: ,总共有2种,
,总共有2种,
故答案为:2.
点评 本题属有机推断题,题目难度中等,涉及结构简式、反应类型、有机反应方程式、同分异构体及有关有机物的计算等知识.试题知识点较多、综合性较强,充分考查学生的分析、理解能力及逻辑推理能力,注意熟练掌握常见有机物结构与性质.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E均为有机物,其中A是化学实验中最常见的有机物,它易溶于水并有特殊香味;B的产量可衡量一个国家石油化工发展的水平,有关物质的转化关系如图①所示:
A、B、C、D、E均为有机物,其中A是化学实验中最常见的有机物,它易溶于水并有特殊香味;B的产量可衡量一个国家石油化工发展的水平,有关物质的转化关系如图①所示: CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去苯中的少量溴:加入CCl4萃取后分液 | |
| B. | 除去乙烷中的乙烯:通入酸性高锰酸钾溶液中 | |
| C. | 除去CO2中的少量HCl气体:通过盛有饱和Na2CO3溶液的洗气瓶 | |
| D. | 除去FeCl2溶液中的少量FeCl3:加入足量Fe粉后过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
| 建筑垃圾 | 二氧化碳 | 氟利昂 | 二氧化硫 |
| 白色污染 | 温室效应 | 臭氧层受损 | 酸雨 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba2+、Na+、I-、ClO- | B. | Mg2+、Cl-、CH3COO-、CO32- | ||
| C. | K+、Cl-、Fe2+、NO3- | D. | Ca2+、Cl-、Na+、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 充电时,阴极反应式:LiCo2-xe-═Li1-xCoO2+xLi+ | |
| B. | 充电时,阳极反应式:6C+xLi++xe-═LixC6 | |
| C. | 充电时,电池的负极与电源的负极相连 | |
| D. | 放电时,Li+向负极移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com