

分析 (1)由铜电极的质量增加,则Cu电极为阴极,可知X为电源的负极;
(2)A中电解氯化钾,生成NaOH,B中电解硫酸铜溶液生成硫酸,根据C中电极反应判断;
(3)B中阳极反应为4OH--4e-═2H2O+O2↑,根据电极反应及电子守恒来计算;
(4)A中发生2KCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2KOH+H2↑+Cl2↑,根据A中的电极反应及与C中转移的电子守恒来计算.
解答 解:(1)由铜电极的质量增加,发生Ag++e-═Ag,则Cu电极为阴极,Ag为阳极,Y为正极,可知X为电源的负极,故答案为:负极;
(2)A中电解氯化钾,生成KOH,所以pH增大,B中电解硫酸铜溶液生成硫酸,溶液中氢离子浓度增大,pH减小,C中阴极反应为Ag++e-═Ag,阳极反应为Ag-e-═Ag+,溶液浓度不变,则pH不变,
故答案为:增大;减小;不变;
(3)C中阴极反应为Ag++e-═Ag,n(Ag)=$\frac{2.16g}{108g/mol}$=0.02mol,则转移的电子为0.02mol,
B中阳极反应为4OH--4e-═2H2O+O2↑,则转移0.02mol电子生成氧气为0.005mol,其体积为0.005mol×22.4L/mol=0.112L=112mL,
则在阴极也生成112mL气体,由2H++2e-═H2↑,则氢气的物质的量为0.005mol,该反应转移的电子为0.01mol,
则Cu2++2e-═Cu中转移0.01mol电子,所以Cu2+的物质的量为0.005mol,通电前c(CuSO4)=$\frac{0.005mol}{0.2L}$=0.025 mol•L-1;
故答案为:4OH--4e-=O2↑+2H2O;0.025;
(4)由A中发生2KCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2KOH+H2↑+Cl2↑~2e-,离子方程式为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑,
由电子守恒可知,转移0.02mol电子时生成0.02molKOH,忽略溶液体积的变化,
则c(OH-)=$\frac{0.02mol}{0.2L}$=0.1mol•L-1,溶液pH=13,
故答案为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑;13.
点评 本题考查电解原理,明确Cu电极的质量增加是解答本题的突破口,并明确发生的电极反应及电子守恒即可解答,注意计算时电子守恒的应用,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

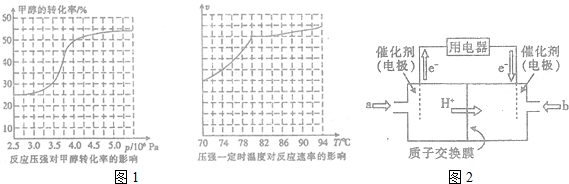
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BrCl的化学性质和Cl2相似,Cl2与水反应是氧化还原反应,BrCl+H2O=HCl+HBrO也是氧化还原反应 | |
| B. | 弱碱性条件下,甲酸乙酯能与氢氧化铜反应,乙酸乙酯也能与氢氧化铜反应 | |
| C. | 苯不能使酸性高锰酸钾褪色,甲苯也不能使酸性高锰酸钾褪色 | |
| D. | CO2与SiO2均为酸性氧化物,CO2能与NaOH溶液反应,SiO2也能与NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
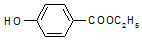 ,生产过程如图:
,生产过程如图: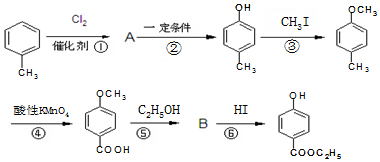
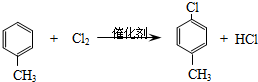 .
. ,-X、-Y为取代基)是对羟基苯甲酸乙酯的同分异构体且能发生银镜反应,则-X的结构简式可能是-OH、-CH2OH 或-OCH3.
,-X、-Y为取代基)是对羟基苯甲酸乙酯的同分异构体且能发生银镜反应,则-X的结构简式可能是-OH、-CH2OH 或-OCH3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放热反应中,反应物的总能量大于生成物的总能量 | |
| B. | 断开化学键的过程会放出能量 | |
| C. | 加热才能发生的反应一定是吸热反应 | |
| D. | 酸碱中和反应都是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O、Na2O2、Al2O3、CuO都是碱性氧化物 | |
| B. | 纯碱、烧碱均属碱类 | |
| C. | NaOH、KOH、Ba(OH)2、Ca(OH)2都是强碱 | |
| D. | HCl、CH3COOH、HNO3都是强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com