
| A. | 浓硫酸 | B. | 五氧二磷 | C. | 碱石灰 | D. | 氯化钙 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 化合反应都是放热反应 | |
| B. | 2 mol气态H2与1 mol气态O2的总能量小于2 mol水蒸气的总能量 | |
| C. | 断裂2 mol氢-氢键、1 mol氧-氧键吸收的总能量大于形成4 mol H-O释放的总能量 | |
| D. | 氢气燃烧过程能量变化可用右图表示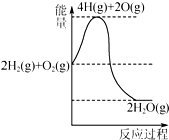 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 A、B、C三个城市全年雨水的月平均pH变化如图所示.
A、B、C三个城市全年雨水的月平均pH变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 电离能/kJ•mol-1 | I1 | I2 |
| 铜 | 746 | 1958 |
| 锌 | 906 | 1733 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 逆反应速率增大,正反应速率减小 | B. | 逆反应速率减小,正反应速率增大 | ||
| C. | 正、逆反应速率都减小 | D. | 正、逆反应速率都增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.4g金属镁所含电子数目为0.2NA | |
| B. | 16g CH4所含原子数目为NA | |
| C. | 1mol氦气中有2NA个氦原子 | |
| D. | 2L 0.3mol•L-1 Na2SO4溶液中含1.2NA个Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | / |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com