
分析 (1)燃烧发生反应:2H2+O2=2H2O(g)、2CO+O2=2CO2、CH4+2O2=CO2+2H2O(g),相同体积的氢气、CO消耗氧气体积相等,假设甲烷为y mL,则氢气、CO总体积为(a-y)mL,根据方程式表示出消耗氧气的体积,进而列方程计算解答;
(2)设H2、CH4、CO的体积分别为zmL、bmL、cmL,根据原子守恒表示出CO2、H2O(g)的体积,再结合总体积列方程解答;结合表达式判断需要知道的数据;
(3)由方程式可知,全部为氢气(或CO)消耗氧气最小,全部为甲烷消耗氧气最多,据此讨论计算解答.
解答 解:(1)假设甲烷为y mL,则氢气、CO总体积为(a-y)mL,则:
CH4+2 O2=CO2+2H2O(g)
y mL 2y mL
由2 H2+O2=2H2O(g)、2CO+O2=2CO2,可知(a-y)mL氢气、CO混合气体消耗氧气为 0.5(a-y)mL
由题意可知,2ymL+0.5(a-y)mL=amL,
解得y=$\frac{1}{3}$a,
即甲烷的体积分数为$\frac{\frac{1}{3}amL}{amL}$×100%=33.3%,
故答案为:33.3%;
(2)设H2、CH4、CO的体积分别为zmL、bmL、cmL,
则:z+b+c=a
根据原子守恒,则:b+c+z+2b=2a,
联立方程,解得b=0.5a
即甲烷的体积分数为$\frac{0.5amL}{amL}$×100%=50%,
要测定原混合气体中H2的体积分数,可以知道:生成CO2气体的总体积,生成H2O(g)的总质量,
故答案为:50%;BC;
(3)全部为氢气(或CO)消耗氧气最小,由2 H2+O2=2H2O(g),可知消耗氧气为0.5amL,全部为甲烷消耗氧气最多,由CH4+2 O2=CO2+2H2O(g),可知消耗氧气为2amL,故0.5a<x<2a,
故答案为:0.5a<x<2a.
点评 本题考查混合物计算、化学方程式有关计算,难度中等,(1)根据方程式判断耗氧量,转化为2组分混合物计算,(3)中注意利用极值法进行解答.


科目:高中化学 来源: 题型:选择题
| A. | A原子最外层电子数比B原子的最外层电子数少 | |
| B. | 将A、B组成原电池时,A为正极 | |
| C. | 1molA从酸中置换生成的H2比1mol B从酸中置换生成的H2多 | |
| D. | 将A和B用导线相连接,一同放入CuSO4溶液中,B的表面有红色的铜析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{1}^{1}$H、${\;}_{1}^{2}$H、${\;}_{1}^{3}$H三种核素的性质不同 | |
| B. | 16O2、18O2彼此是同位素 | |
| C. | 14N、14C两种核素的中子数相同,质子数不同 | |
| D. | 白磷与红磷是磷元素的两种同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

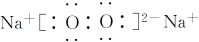
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
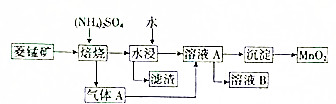 锰是重要的金属元素,制备单质锰的方法之一是先获得高纯度的二氧化锰,然后用还原剂还原MnO2,从低品位的菱锰矿(主要成分是MnCO3)中获得高纯度的MnO2的流程图如下(已知常温下MnCO3的Ksp=9×10-11;离子浓度小于1.0×10-5mol•L-时,即可认为该离子沉淀完全):
锰是重要的金属元素,制备单质锰的方法之一是先获得高纯度的二氧化锰,然后用还原剂还原MnO2,从低品位的菱锰矿(主要成分是MnCO3)中获得高纯度的MnO2的流程图如下(已知常温下MnCO3的Ksp=9×10-11;离子浓度小于1.0×10-5mol•L-时,即可认为该离子沉淀完全):查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;写出A分子中官能团的名称羧基、羟基;
;写出A分子中官能团的名称羧基、羟基;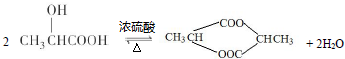 ;
;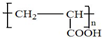 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱电解质 | HCOOH | HCN | H2CO3 | NH3•H2O |
| 电离平衡常数 (25℃) | Ka=1.8×10-4 | Ka=4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Kb=1.8×10-5 |
| A. | 由上表可知酸性HCOOH>H2CO3 | |
| B. | 0.1mol/L的HCOONH4溶液中:c(HCOO-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 0.1mol/L的NaHCO3溶液中:c(H2CO3)+c(H+)=c(OH-)+c(CO32-) | |
| D. | 结合H+的能力:CO32->HCO3->CN->HCOO- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com